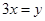题目内容
在CuO和铁粉的混合物中,加入一定量的稀硫酸并微热。当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下列结论中正确的是( )
| A.不溶物一定是Cu | B.不溶物一定含铜,但不一定含铁 |
| C.不溶物一定是Fe | D.溶液中一定含有Fe2+,但不一定含有Cu2+ |
B
涉及反应为:
CuO+2H+=Cu2++H2O Fe+2H+=Fe2++H2↑ Fe+Cu2+=Fe2++Cu
向向滤液中插入一枚铁钉,发现铁钉并无任何变化,说明滤液中已经不含H+、Cu2+,那么铜元素已经全部存在于不溶物中;
如果铁过量,不溶物中也可能含有铁,故答案为B
CuO+2H+=Cu2++H2O Fe+2H+=Fe2++H2↑ Fe+Cu2+=Fe2++Cu
向向滤液中插入一枚铁钉,发现铁钉并无任何变化,说明滤液中已经不含H+、Cu2+,那么铜元素已经全部存在于不溶物中;
如果铁过量,不溶物中也可能含有铁,故答案为B

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目


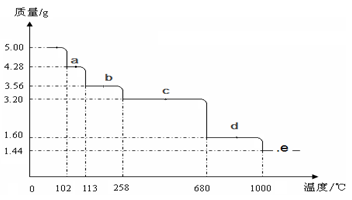
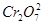 )废水用硫酸亚铁铵[
)废水用硫酸亚铁铵[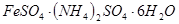 ]处理,反应中铁元素和铬元素
]处理,反应中铁元素和铬元素 完全转化为沉淀,该沉淀干燥后得到
完全转化为沉淀,该沉淀干燥后得到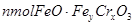 ,不考虑处理过程中的实际损耗,下列叙述错误的是
,不考虑处理过程中的实际损耗,下列叙述错误的是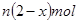
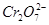 的物质的量为
的物质的量为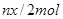
 生转移的电子数为
生转移的电子数为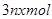
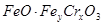 当中
当中