题目内容
【题目】(1)某元素的原子最外层电子排布为3s23p2,它的次外层上电子云形状有_____种,原子中所有电子占有____个轨道,核外共有____________种运动状态。
(2)用镁粉、碱金属盐及碱土金属盐等可以做成烟火。燃放时,烟火发出五颜六色的光,请用原子结构的知识解释发光的原因:______________________________________。
(3)下图中能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是____。
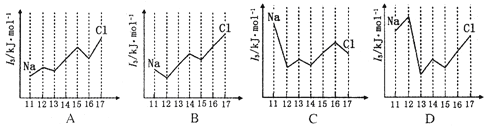
【答案】 2 8 14 电子从能量较高的轨道跃迁到能量较低的轨道时,以发光的形式释放能量 D
【解析】(1)某元素的基态原子最外层电子排布为3s23p2,则该元素的原子序数是14,是Si元素;它的次外层是L层,其电子云形状有2种,原子中所有电子占有8个轨道,核外共有14个不同运动状态的电子;(2)原子核外电子按一定轨道顺序排列,轨道离核越远,能量越高。燃烧时,电子获得能量,从内侧轨道跃迁到外侧的另一条轨道。跃迁到新轨道的电子处在一种不稳定的状态,它随即就会跳回原来轨道,并向外界释放能量(光能);(3)镁失去2个电子后,就已经达到稳定结构,所以镁的第三电离能最大,答案选D。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】加热NaHCO3的饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)写出NaHCO3水解的离子方程式__________,甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强。
(2)乙同学认为溶液的pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_______NaHCO3(选填“>”、“<”或“=”)
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_______(选填“甲”或“乙”)判断正确。试剂X是_________。
A. Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
②将加热后的溶液冷却到10℃,若溶液的pH____8.3(选填“>”、“<”或“=”),则__________(选填“甲”或“乙”)判断正确。
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言_____(选填“甲”或“乙”)的判断是错误的,理由是______________________。