题目内容
(6分)某溶液中可能含有OH—,CO32—,AlO2—,SiO32—,SO42—,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:
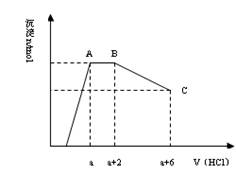
回答下列问题:(已知:AlO2—+HCO3—+H2O=Al(OH)3↓+ CO32—)
(1)原混合溶液中一定含有的离子是:___________________________________;
(2)AB段反应的离子方程式是:____________________________________________;
(3)发生AB段反应的离子与发生BC段反应的物质两者物质的量之比为:____________。

回答下列问题:(已知:AlO2—+HCO3—+H2O=Al(OH)3↓+ CO32—)
(1)原混合溶液中一定含有的离子是:___________________________________;
(2)AB段反应的离子方程式是:____________________________________________;
(3)发生AB段反应的离子与发生BC段反应的物质两者物质的量之比为:____________。
(1)OH—,CO32—,AlO2—,SiO32— (2)H++ CO32—= HCO3— H++ HCO3—=CO2↑+H2O
(3)n(CO32—):n[Al(OH)3]=3:4
(3)n(CO32—):n[Al(OH)3]=3:4
加入盐酸扣,一开始没有沉淀生成,故说明原溶液为碱性,一定存在大量的OH—,排除Fe3+,Mg2+,Al3+的大量存在;
沉淀部分溶解,说明一定存在AlO2—及SiO32—:
SiO32-+2H+=H2SiO3↓(硅酸不溶解酸)
AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O
而A—B段的存在,说明原溶液中存在CO32—:H++ CO32—= HCO3— H++ HCO3—=CO2↑+H2O
注:由AlO2—+HCO3—+H2O=Al(OH)3↓+ CO32—可知,AlO2—先于HCO3—结合H+,待CO32—结合H+生成弱酸碳酸后,Al(OH)3再溶解于过量的盐酸中
(3)由所加盐酸的量可知:
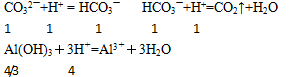
其中:n(CO32—):n[Al(OH)3]=3:4
沉淀部分溶解,说明一定存在AlO2—及SiO32—:
SiO32-+2H+=H2SiO3↓(硅酸不溶解酸)
AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O
而A—B段的存在,说明原溶液中存在CO32—:H++ CO32—= HCO3— H++ HCO3—=CO2↑+H2O
注:由AlO2—+HCO3—+H2O=Al(OH)3↓+ CO32—可知,AlO2—先于HCO3—结合H+,待CO32—结合H+生成弱酸碳酸后,Al(OH)3再溶解于过量的盐酸中
(3)由所加盐酸的量可知:
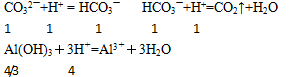
其中:n(CO32—):n[Al(OH)3]=3:4

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
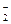 +xI—+yH+=bNO↑+cI2+zH2O,
+xI—+yH+=bNO↑+cI2+zH2O,