题目内容
【题目】I.下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):

请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是_____
A.c(H+) B.c(H+)·c(OH-) C. ![]()
(2)CH3COONH4的水溶液呈_______(选填酸性”、“中性"或“碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因______。
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5mol·L-1]时,溶液中c(CO32-)=_____mol/L。
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) △H=akJ/mol
CH3CH2OH(g)+3H2O(g) △H=akJ/mol
在一定压强下,测得.上述反应的实验数据如下表。

根据表中数据分析:
①上述反应的a_____0(填"大于”或“小于”)。
②在一定温度下.提高氢碳[即![]() ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
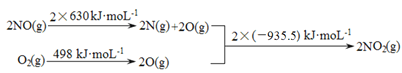
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为____________。
【答案】 A 中性 显酸性 1.4×10-2 小于 不变 2CO(g)+4H2(g)==CH3CH2OH(g)+H2O(g) △H=-E2kJ/mol
【解析】Ⅰ、(1)用蒸馏水稀释0.1mol/L的醋酸溶液,溶液浓度减小,醋酸电离平衡正向移动,但温度不变,水和酸的电离平衡常数不变,A.c(H+)变小,符合条件,选项A选;B.温度不变,水的离子积不变,c(H+)·c(OH-)不变,选项B不选;C. 温度不变,醋酸的电离平衡常数不变,![]() 不变,选项C不选。答案选A;(2) CH3COOH和NH3H2O的电离常数相等,CH3COO-和NH4+的水解程度相同,故CH3COONH4的水溶液呈中性;(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液,因为Ka3=4.0×10-7,,Kh2=
不变,选项C不选。答案选A;(2) CH3COOH和NH3H2O的电离常数相等,CH3COO-和NH4+的水解程度相同,故CH3COONH4的水溶液呈中性;(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液,因为Ka3=4.0×10-7,,Kh2=![]() <Ka3,即HC6H5O7-水解程度小于其电离程度,所以该溶液显酸性;(4)c(Ni2+)=1×10-5mol·L-1,Ksp(NiCO3)=c(Ni2+) c(CO32-)=1×10-5mol·L-1×c(CO32-)=1.4×10-7,c(CO32-)= 1.4×10-2 mol·L-1。II.(1)①由表中信息可知,二氧化碳的转化率随温度升高而减小,说明该反应为放热反应,故上述反应的a小于0;②平衡常数只与温度有关,故在一定温度下,提高氢碳(即
<Ka3,即HC6H5O7-水解程度小于其电离程度,所以该溶液显酸性;(4)c(Ni2+)=1×10-5mol·L-1,Ksp(NiCO3)=c(Ni2+) c(CO32-)=1×10-5mol·L-1×c(CO32-)=1.4×10-7,c(CO32-)= 1.4×10-2 mol·L-1。II.(1)①由表中信息可知,二氧化碳的转化率随温度升高而减小,说明该反应为放热反应,故上述反应的a小于0;②平衡常数只与温度有关,故在一定温度下,提高氢碳(即![]() )比,K值不变;(2) 根据上图可知反应为放热反应,反应的热化学方程式为2CO(g)+4H2(g)==CH3CH2OH(g)+H2O(g) △H=-E2kJ/mol。
)比,K值不变;(2) 根据上图可知反应为放热反应,反应的热化学方程式为2CO(g)+4H2(g)==CH3CH2OH(g)+H2O(g) △H=-E2kJ/mol。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数