ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ…ιΜ·οΊΘ®GaAsΘ© «”≈ΝΦΒΡΑκΒΦΧε≤ΡΝœΘ§Ω…”Ο”Ύ÷ΤΉςΈΔ–ΆΦΛΙβΤςΜρΧΪ―τΡήΒγ≥ΊΒΡ≤ΡΝœΒ»Θ°ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©–¥≥ωΜυΧ§As‘≠Ή”ΒΡΚΥΆβΒγΉ”≈≈≤Φ Ϋ Θ°
Θ®2Θ©ΗυΨί‘ΣΥΊ÷ήΤΎ¬…Θ§‘≠Ή”ΑκΨΕGaAsΘ§ΒΎ“ΜΒγάκΡήGaAsΘ°Θ®ΧνΓΑ¥σ”ΎΓ±ΜρΓΑ–Γ”ΎΓ±Θ©
Θ®3Θ©AsCl3Ζ÷Ή”ΒΡΝΔΧεΙΙ–ΆΈΣ Θ§ Τδ÷–AsΒΡ‘”Μ·ΙλΒάάύ–ΆΈΣ Θ°
Θ®4Θ©GaF3ΒΡ»έΒψΗΏ”Ύ1000ΓφΘ§GaCl3ΒΡ»έΒψΈΣ77.9ΓφΘ§Τδ‘≠“ρ « Θ°
Θ®5Θ©GaAsΒΡ»έΒψΈΣ1238ΓφΘ§ΟήΕ»ΈΣΠ― gcm©¹3 Θ§ ΤδΨßΑϊΫαΙΙ»γΆΦΥυ ΨΘ°ΗΟΨßΧεΒΡάύ–ΆΈΣ Θ§ Ga”κAs“‘ΦϋΦϋΚœΘ°GaΚΆAsΒΡΡΠΕϊ÷ ΝΩΖ÷±πΈΣMGa gmol©¹1ΚΆMAs gmol©¹1 Θ§ ‘≠Ή”ΑκΨΕΖ÷±πΈΣrGa pmΚΆrAs pmΘ§ΑΔΖϋΌΛΒ¬¬ό≥Θ ΐ÷ΒΈΣNA Θ§ ‘ρGaAsΨßΑϊ÷–‘≠Ή”ΒΡΧεΜΐ’ΦΨßΑϊΧεΜΐΒΡΑΌΖ÷¬ ΈΣ Θ° 
ΓΨ¥πΑΗΓΩ
Θ®1Θ©1s22s22p63s23p63d104s24p3
Θ®2Θ©¥σ”ΎΘΜ–Γ”Ύ
Θ®3Θ©»ΐΫ«ΉΕ–ΈΘΜsp3
Θ®4Θ©GaF3ΈΣάκΉ”ΨßΧεΘ§GaCl3ΈΣΖ÷Ή”ΨßΧεΘ§άκΉ”ΨßΧεΒΡ»έΒψΗΏ
Θ®5Θ©‘≠Ή”ΨßΧεΘΜΙ≤ΦέΘΜ![]() ΓΝ100%
ΓΝ100%
ΓΨΫβΈωΓΩΫβΘΚΘ®1.Θ©AsΈΣΔθAΉε33Κ≈‘ΣΥΊΘ§ΒγΉ”≈≈≤Φ ΫΈΣΘΚ1s22s22p63s23p63d104s24p3 Θ§ Ι ¥πΑΗΈΣΘΚ1s22s22p63s23p63d104s24p3ΘΜ
Θ®2.Θ©ΗυΨί‘ΣΥΊ÷ήΤΎ¬…Θ§Ga”κAsΈΜ”ΎΆ§“Μ÷ήΤΎΘ§Ga‘≠Ή”–ρ ΐ–Γ”ΎAsΘ§Ι ΑκΨΕGa¥σ”ΎAsΘ§Ά§÷ήΤΎΒΎ“ΜΒγάκΡή¥”ΉσΒΫ”“Θ§÷πΫΞ‘ω¥σΘ§Ι ΒΎ“ΜΒγάκΡήGa–Γ”ΎAsΘ§Ι ¥πΑΗΈΣΘΚ¥σ”ΎΘΜ–Γ”ΎΘΜ
Θ®3.Θ©AsCl3÷–Φέ≤ψΒγΉ”Ε‘Ηω ΐ=Π“ΦϋΗω ΐ+Ι¬ΒγΉ”Ε‘Ηω ΐ=3+ ![]() =4Θ§Υυ“‘‘≠Ή”‘”Μ·ΖΫ Ϋ «sp3 Θ§ ”…”Ύ”–“ΜΕ‘Ι¬Ε‘ΒγΉ”Ε‘Θ§Ζ÷Ή”Ω’ΦδΙΙ–ΆΈΣ»ΐΫ«ΉΕ–ΈΘ§Ι ¥πΑΗΈΣΘΚ»ΐΫ«ΉΕ–ΈΘΜsp3ΘΜ
=4Θ§Υυ“‘‘≠Ή”‘”Μ·ΖΫ Ϋ «sp3 Θ§ ”…”Ύ”–“ΜΕ‘Ι¬Ε‘ΒγΉ”Ε‘Θ§Ζ÷Ή”Ω’ΦδΙΙ–ΆΈΣ»ΐΫ«ΉΕ–ΈΘ§Ι ¥πΑΗΈΣΘΚ»ΐΫ«ΉΕ–ΈΘΜsp3ΘΜ
Θ®4.Θ©GaF3ΒΡ»έΒψΗΏ”Ύ1000ΓφΘ§GaCl3ΒΡ»έΒψΈΣ77.9ΓφΘ§Τδ‘≠“ρ «GaF3ΈΣάκΉ”ΨßΧεΘ§GaCl3ΈΣΖ÷Ή”ΨßΧεΘ§άκΉ”ΨßΧεΒΡ»έΒψΗΏΘ§
Ι ¥πΑΗΈΣΘΚGaF3ΈΣάκΉ”ΨßΧεΘ§GaCl3ΈΣΖ÷Ή”ΨßΧεΘ§άκΉ”ΨßΧεΒΡ»έΒψΗΏΘΜ
Θ®5.Θ©GaAsΒΡ»έΒψ1238ΓφΘ§»έΒψΫœΗΏΘ§“‘Ι≤ΦέΦϋΫαΚœ–Έ≥… τ”Ύ‘≠Ή”ΨßΧεΘ§ΟήΕ»ΈΣΠ― gcm©¹3 Θ§ ΗυΨίΨυΧ·Ζ®ΦΤΥψΘ§AsΘΚ ![]() Θ§GaΘΚ4ΓΝ1=4Θ§Ι ΤδΨßΑϊ÷–‘≠Ή”Υυ’ΦΒΡΧεΜΐV1=Θ®
Θ§GaΘΚ4ΓΝ1=4Θ§Ι ΤδΨßΑϊ÷–‘≠Ή”Υυ’ΦΒΡΧεΜΐV1=Θ® ![]() Θ©ΓΝ10©¹30 Θ§ ΨßΑϊΒΡΧεΜΐV2=
Θ©ΓΝ10©¹30 Θ§ ΨßΑϊΒΡΧεΜΐV2= ![]() =
= 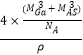 Θ§Ι GaAsΨßΑϊ÷–‘≠Ή”ΒΡΧεΜΐ’ΦΨßΑϊΧεΜΐΒΡΑΌΖ÷¬ ΈΣ
Θ§Ι GaAsΨßΑϊ÷–‘≠Ή”ΒΡΧεΜΐ’ΦΨßΑϊΧεΜΐΒΡΑΌΖ÷¬ ΈΣ ![]() ΫΪV1ΓΔV2¥χ»κΦΤΥψΒΟΑΌΖ÷¬ =
ΫΪV1ΓΔV2¥χ»κΦΤΥψΒΟΑΌΖ÷¬ = ![]() ΓΝ100%Θ§Ι ¥πΑΗΈΣΘΚ‘≠Ή”ΨßΧεΘΜΙ≤ΦέΘΜ
ΓΝ100%Θ§Ι ¥πΑΗΈΣΘΚ‘≠Ή”ΨßΧεΘΜΙ≤ΦέΘΜ ![]() ΓΝ100%Θ°
ΓΝ100%Θ°
Θ®1.Θ©AsΈΣΔθAΉε33Κ≈‘ΣΥΊΘ§ΒγΉ”≈≈≤Φ ΫΈΣΘΚ1s22s22p63s23p63d104s24p3ΘΜ
Θ®2.Θ©Ά§“Μ÷ήΤΎΘ§‘≠Ή”–ρ ΐ‘Ϋ–ΓΑκΨΕ‘Ϋ¥σΘ§Ά§÷ήΤΎΒΎ“ΜΒγάκΡή¥”ΉσΒΫ”“Θ§÷πΫΞ‘ω¥σΘΜ
Θ®3.Θ©AsCl3÷–Φέ≤ψΒγΉ”Ε‘Ηω ΐ=Π“ΦϋΗω ΐ+Ι¬ΒγΉ”Ε‘Ηω ΐ=3+ ![]() =4Θ§Υυ“‘‘≠Ή”‘”Μ·ΖΫ Ϋ «sp3 Θ§ ”…”Ύ”–“ΜΕ‘Ι¬Ε‘ΒγΉ”Ε‘Θ§Ζ÷Ή”Ω’ΦδΙΙ–ΆΈΣ»ΐΫ«ΉΕ–ΈΘΜ
=4Θ§Υυ“‘‘≠Ή”‘”Μ·ΖΫ Ϋ «sp3 Θ§ ”…”Ύ”–“ΜΕ‘Ι¬Ε‘ΒγΉ”Ε‘Θ§Ζ÷Ή”Ω’ΦδΙΙ–ΆΈΣ»ΐΫ«ΉΕ–ΈΘΜ
Θ®4.Θ©GaF3ΒΡ»έΒψΗΏ”Ύ1000ΓφΘ§GaCl3ΒΡ»έΒψΈΣ77.9ΓφΘ§Τδ‘≠“ρ «GaF3ΈΣάκΉ”ΨßΧεΘ§GaCl3ΈΣΖ÷Ή”ΨßΧεΘ§άκΉ”ΨßΧεΒΡ»έΒψΗΏΘΜ
Θ®5.Θ©GaAsΒΡ»έΒψΈΣ1238ΓφΘ§»έΒψΫœΗΏΘ§“‘Ι≤ΦέΦϋΫαΚœ–Έ≥… τ”Ύ‘≠Ή”ΨßΧεΘ§ΟήΕ»ΈΣΠ― gcm©¹3 Θ§ ΗυΨίΨυΧ·Ζ®ΦΤΥψΘ§AsΘΚ ![]() Θ§GaΘΚ4ΓΝ1=4Θ§Ι ΤδΨßΑϊ÷–‘≠Ή”Υυ’ΦΒΡΧεΜΐV1=Θ®
Θ§GaΘΚ4ΓΝ1=4Θ§Ι ΤδΨßΑϊ÷–‘≠Ή”Υυ’ΦΒΡΧεΜΐV1=Θ® ![]() Θ©ΓΝ10©¹30 Θ§ ΨßΑϊΒΡΧεΜΐV2=
Θ©ΓΝ10©¹30 Θ§ ΨßΑϊΒΡΧεΜΐV2= ![]() =
=  Θ§Ι GaAsΨßΑϊ÷–‘≠Ή”ΒΡΧεΜΐ’ΦΨßΑϊΧεΜΐΒΡΑΌΖ÷¬ ΈΣ
Θ§Ι GaAsΨßΑϊ÷–‘≠Ή”ΒΡΧεΜΐ’ΦΨßΑϊΧεΜΐΒΡΑΌΖ÷¬ ΈΣ ![]() ΫΪV1ΓΔV2¥χ»κΦΤΥψΒΟΑΌΖ÷¬ =
ΫΪV1ΓΔV2¥χ»κΦΤΥψΒΟΑΌΖ÷¬ = ![]() ΓΝ100%
ΓΝ100%

ΓΨΧβΡΩΓΩάϊ”Ο”“ΆΦΥυ ΨΉΑ÷ΟΫχ––œ¬Ν– Β―ιΘ§Ρή’ΐ»ΖΫχ–– Β―ι≤ΔΒΟ≥ωœύ”Π Β―ιΫα¬έΒΡ «Θ® Θ©
―Γœν | ΔΌ | ΔΎ | Δέ | Β―ιΫα¬έ |
|
A | ≈®Α±Υ° | CaO | AlCl3»ή“Κ | ÷Τ±Η«β―θΜ·¬Ν | |
B | NaCl»ή“Κ | Βγ · | Υα–‘KMnO4 | ““»≤ΨΏ”–ΜΙ‘≠–‘ | |
C | ≈®œθΥα | Na2CO3 | Na2SiO3»ή“Κ | Ζ«Ϋπ τ–‘ΘΚNΘΨCΘΨSi | |
D | œΓΝρΥα | Na2S | Ag2SO4Ή«“Κ | Ksp(Ag2SO4)ΘΨKsp(Ag2S) |
A. A B. B C. C D. D



