题目内容
 实验化学
实验化学已知:苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸,其反应原理为:
2C6H5-CHO+NaOH→C6H5-CH2OH+C6H5-COONa
实验步骤如下:
①向如图所示装置中加入适量NaOH、水和苯甲醛,混匀、加热,使反应充分进行.
②从冷凝管上口加入冷水,混匀,冷却.倒入分液漏斗,用乙醚萃取、分液.水层保留待用.将乙醚层依次用10%碳酸钠溶液、水洗涤.
③将乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中,混匀、静置后将其转入蒸馏装置,缓慢均匀加热除去乙醚,收集198℃~204℃馏分得苯甲醇.
④将步骤②中的水层和适量浓盐酸混合均匀,析出白色固体.冷却、抽滤得粗产品,将粗产品提纯得苯甲酸.
(1)步骤②中,最后用水洗涤的作用是
除去NaOH、苯甲酸钠和碳酸钠等杂质
除去NaOH、苯甲酸钠和碳酸钠等杂质
.将分液漏斗中两层液体分离开的实验操作方法是:先把下层液体从下端放出
把下层液体从下端放出
后把上层液体从上口倒出
把上层液体从上口倒出
.(2)步骤③中无水硫酸镁的作用是
干燥剂
干燥剂
.(3)步骤④中水层和浓盐酸混合后发生反应的化学方程式为
C6H5COONa+HCl→C6H5COOH+NaCl
C6H5COONa+HCl→C6H5COOH+NaCl
;将反应后混合物冷却的目的是使苯甲酸尽可能多的析出
使苯甲酸尽可能多的析出
.(4)抽滤装置所包含的仪器除减压系统外,还有
吸滤瓶
吸滤瓶
、布氏漏斗
布氏漏斗
(填仪器名称).分析:(1)水洗的目的是洗去除去NaOH、苯甲酸钠和碳酸钠等杂质;分液操作是遵循“上吐下泻:操作进行分离;
(2)乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中,混匀是为干燥乙醚层;
(3)步骤②中的水层和适量浓盐酸混合均匀,析出白色固体为苯甲酸,是苯甲酸钠和盐酸反应得到,混合物冷却减小苯甲酸溶解度易于析出晶体;
(4)依据抽滤装置回答.
(2)乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中,混匀是为干燥乙醚层;
(3)步骤②中的水层和适量浓盐酸混合均匀,析出白色固体为苯甲酸,是苯甲酸钠和盐酸反应得到,混合物冷却减小苯甲酸溶解度易于析出晶体;
(4)依据抽滤装置回答.
解答:解:(1)依据实验操作步骤分析可知,步骤②中,最后用水洗涤的作用是洗去NaOH、苯甲酸钠和碳酸钠等杂质,分液操作是把下层液体从下端放出; 把上层液体从上口倒出,
故答案为:除去NaOH、苯甲酸钠和碳酸钠等杂质;把下层液体从下端放出;把上层液体从上口倒出;
(2)将乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中利用硫酸镁干燥乙醚层,故答案为:干燥剂;
(3)步骤②中的水层和适量浓盐酸混合均匀,析出白色固体为苯甲酸,是苯甲酸钠和盐酸反应得到,反应的化学方程式为:C6H5COONa+HCl→C6H5COOH+NaCl;混合物冷却减小苯甲酸溶解度易于析出晶体,
故答案为:C6H5COONa+HCl→C6H5COOH+NaCl;使苯甲酸尽可能多的析出;
(4)抽滤装置所包含的仪器除减压系统外,需要吸滤瓶和布氏漏斗,故答案为:吸滤瓶;布氏漏斗.
故答案为:除去NaOH、苯甲酸钠和碳酸钠等杂质;把下层液体从下端放出;把上层液体从上口倒出;
(2)将乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中利用硫酸镁干燥乙醚层,故答案为:干燥剂;
(3)步骤②中的水层和适量浓盐酸混合均匀,析出白色固体为苯甲酸,是苯甲酸钠和盐酸反应得到,反应的化学方程式为:C6H5COONa+HCl→C6H5COOH+NaCl;混合物冷却减小苯甲酸溶解度易于析出晶体,
故答案为:C6H5COONa+HCl→C6H5COOH+NaCl;使苯甲酸尽可能多的析出;
(4)抽滤装置所包含的仪器除减压系统外,需要吸滤瓶和布氏漏斗,故答案为:吸滤瓶;布氏漏斗.
点评:本题考查了物质制备实验的过程分析判断,反应实质和反应条件的分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目





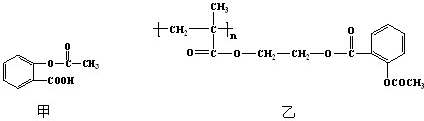



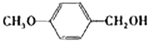
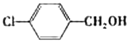
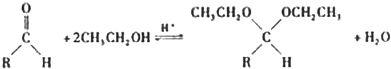
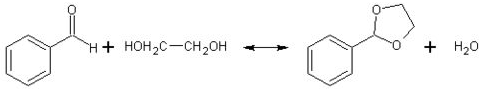
 C6H5―CH2OH+C6H5―COONa
C6H5―CH2OH+C6H5―COONa