题目内容
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点
(1)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,其相关反应的主要热化学方程式如下:
反应①:NH3(aq)+HClO(aq)= NH2Cl(aq)+H2O(l)△H1= akJmol﹣1
反应②:NH2Cl(aq)+HClO(aq)= NHCl2(aq)+H2O(I)△H2= bkJmol﹣1
反应③:2NHCl2(aq)+H2O(l)= N2(g)+HClO(aq)+3HCl(aq)△H3= ckJmol﹣1
① 2NH3(aq)+3HClO(aq)= N2(g)+3H2O(I)+3HCl(aq)的△H=______。
② 溶液pH对次氯酸钠去除氨氮有较大的影响(如图1所示)。在pH较低时溶液中有无色无味的气体生成,氨氮去除效率较低,其原因是_________________。
③ 用电化学法也可以去除废水中氨氮.在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高。反应装置如图2所示,b为电极__极,电解时阴极的电极反应式为_____________。

(2)“低碳经济”正成为科学家研究的主要课题。
① 以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是__________________。
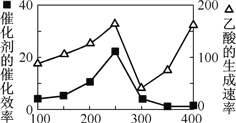
② 为了提高该反应中CO2的转化率,可以采取的措施是_____________。(写一条即可)
【答案】(2a+2b+c)kJmol﹣1HCl与NaClO反应生成HClO,HClO分解生成O2,与氨氮反应的HClO减少正极2H2O+2NH4++2e-=2NH3H2O+H2↑ 或 2H++2e-=H2↑温度超过250℃时,催化剂的催化效率降低增大反应压强或增大CO2的浓度
【解析】试题分析:以资源合理利用、环境保护为载体,考查盖斯定律的应用、电解原理、溶液的酸碱性对化学反应的影响、化学反应速率、化学平衡等知识,考查学生的读图能力和对图标的分析能力。
解析:(1)①根据盖斯定律,待计算的反应=2×①+2×②+③,所以反应的△H=(2a+2b+c)kJmol-1 。答案:(2a+2b+c)kJmol-1 。
②从图中可以看出,溶液pH较小时,次氯酸钠对氨氮去除率下降,而此时溶液中c(HClO)应当较pH大时更高,所以溶液中HClO一定参与了其它反应,结合溶液的组成及HClO的性质,HClO可能分解也可能与HCl反应生成Cl2,题目中已经说明“有无色无味的气体生成”,则应当是HClO的分解。答案:HCl与NaClO反应生成HClO,HClO分解生成O2,与氨氮反应的HClO减少。
③用惰性电极直接电解硫酸铵溶液相当于电解水,两极分别生成H2和O2,溶液中的氨氮不会直接消耗,也不会与产生的H2或O2反应,所以效率一定很差。加入NaCl后,电解仍然无法直接消耗氨氮,但是生成的氯气可以转变成HClO从而去除氨氮,因此Cl气必须从溶液下方产生,然后因此水充分接触得到HClO。所以a为电源负极,b为正极,阴极反应为2H++2e-=H2↑,溶液中H+主要来源于NH4+水解,则电极反应无也可以认为是NH4+和H2O。答案:正极 2H2O+2NH4++2e-=2NH3H2O+H2↑ 或 2H++2e-=H2↑
(2) ①读图可知,250~300 ℃时,不但乙酸的生成速率较低,而且催化剂的催化效率也很低,在其他条件不变的情况下,产生乙酸生成速率降低的原因是催化剂催化效率降低。答案:温度超过250℃时,催化剂的催化效率降低
②转化反应为CO2(g)+CH4(g)→CH3COOH(g),提高CO2的转化率可以是其他条件不变时设法使化学平衡正向移动,此处只能是加压。而若单从提高CO2转化率角度看,加入过量的CH4也可以实现这一目标。答案: 增大反应体系压强或充入更多的CH4。

