题目内容
某同学在实验室研究Fe与H2SO4的反应
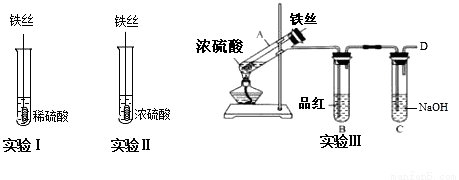
【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__.
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为__.
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是__,装置C的作用是__.
(4)实验Ⅲ结束后,
甲同学认为装置C中产生Na2SO3,
乙同学认为SO2过量,产物中还可能含有_________,
丙同学认为可能还含有Na2SO4,设计简单实验验证是否含有SO42-,正确的是(____)
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的S元素,稀硫酸的氧化性源于________.
②影响反应产物多样性的因素有_____________________(至少填两个).
练习册系列答案
相关题目



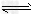 Cr2O72-+H2O
Cr2O72-+H2O Na2CrO4+NaFeO2+ ;
Na2CrO4+NaFeO2+ ;
 Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
 SO2↑+4NO2↑+2H2O B. HNO3+NaOH=NaNO3+H2O
SO2↑+4NO2↑+2H2O B. HNO3+NaOH=NaNO3+H2O
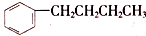 的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)( )
的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)( )