题目内容
在热的稀硫酸溶液中溶解了11.4g FeSO4,当加入50mL 0.5mol?L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是( )
分析:先根据化合价的升降判断氧化剂和还原剂,然后根据氧化还原反应中得失电子数相等判断该氧化物的化学式.
解答:解:该反应中,Fe2+失电子Fe3+,所以硫酸亚铁作还原剂;硝酸中氮元素得电子化合价降低作氧化剂;
硫酸亚铁的物质的量=
=0.075mol,所以硫酸亚铁生成硫酸铁失去0.075mol电子;
根据氧化还原反应中得失电子数相等可知,硝酸中氮元素得到0.075mol电子,硝酸的物质的量=硝酸钾的物质的量=0.5mol?L-1 ×0.05L=0.025mol,
所以硝酸的物质的量和电子的物质的量之比=0.025mol:0.075mol=1:3,既一个氮原子得到3个电子变成+2价,所以该氮的氧化物是NO,
故选B.
硫酸亚铁的物质的量=
| 11.4g |
| 152g/mol |
根据氧化还原反应中得失电子数相等可知,硝酸中氮元素得到0.075mol电子,硝酸的物质的量=硝酸钾的物质的量=0.5mol?L-1 ×0.05L=0.025mol,
所以硝酸的物质的量和电子的物质的量之比=0.025mol:0.075mol=1:3,既一个氮原子得到3个电子变成+2价,所以该氮的氧化物是NO,
故选B.
点评:本题考查氧化还原反应,明确氧化还原反应中得失电子相等是解本题的关键,难度不大.

练习册系列答案
相关题目
 (2007?淄博三模)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白:
(2007?淄博三模)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白: 对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.
对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.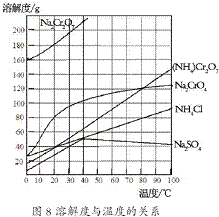 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下: