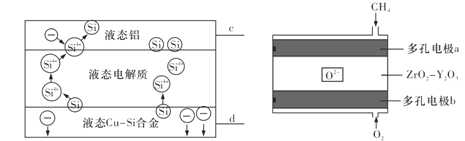
题目内容
【题目】已知25℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)=1.3×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液。下列叙述中不正确的是
A.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
【答案】D
【解析】
依据氯化银和碘化银的溶度积比较溶解度,反应向更难溶的方向进行;依据碘化银和氯化银溶度积比较溶解度可知,碘化银溶解度小,反应中先析出碘化银; AgCl饱和溶液中c(Ag+)为1.30×10-5molL-1,溶液中存在沉淀溶解平衡AgCl(s)Ag++Cl-,氯离子浓度为1.30×10-5molL-1;依据Ksp=c(Ag+)c(Cl-)计算得到;根据溶解度判断沉淀的先后顺序,利用溶度积常数计算出各离子浓度,结合反应的程度比较溶液离子浓度的大小。
A.碘化银和氯化银溶度积比较溶解度可知,碘化银溶解度小,若在AgCl悬浊液中滴加KI溶液,如满足c(Ag+)c(I)>Ksp(AgI),则可生成黄色沉淀;
B.由已知条件知, AgI的Ksp较小,则先产生的是AgI沉淀,故B正确;
C.在AgCl饱和溶液中c(Ag+)=1.30×105molL1,溶液中存在沉淀溶解平衡AgCl(s)Ag++Cl,c(Cl-)=1.30×105molL1,由Ksp=c(Ag+)c(Cl-)=1.30×105molL1×1.30×105molL1=1.69×1010 mol2L2,故C正确;
D.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,首先生成AgI沉淀,反应后剩余n(Ag+)=0.003L×0.01mol/L=3×105mol,继续生成AgCl沉淀,反应后剩余n(Cl)=0.005×0.01mol/L3×105mol=2×105mol,c(Cl)=![]() =1.53×103mol/L,浊液中c(Ag+)═
=1.53×103mol/L,浊液中c(Ag+)═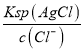 =
=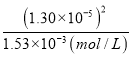 =1.1×107(mol/L),c(I)═
=1.1×107(mol/L),c(I)═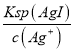 =
=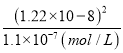 =1.35×109(mol/L),混合溶液中n(K+)=1×104mol,n(NO3)=0.008L×0.01mol/L=8×105mol,则c(K+)>c(NO3),故c(K+)>c(NO3)>c(Cl)>c(Ag+)>c(I),故D错误;
=1.35×109(mol/L),混合溶液中n(K+)=1×104mol,n(NO3)=0.008L×0.01mol/L=8×105mol,则c(K+)>c(NO3),故c(K+)>c(NO3)>c(Cl)>c(Ag+)>c(I),故D错误;
答案选D。