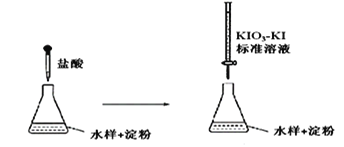
题目内容
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。

(1)若A为短周期元素的金属单质,D为短周期元素的非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为_____________。
(2)若A是常见的金属单质,D、F是气体单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是________________。已知1g D与F反应生成B(气态)时放出92.3kJ热量,写出该反应的热化学方程式:_______________________。
(3)若A、D、F都是短周期非金属元素的单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________,B固体属于____________晶体。
【答案】 C + 4HNO3(浓)=4NO2 ↑+ CO2 ↑+2H2O 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- H2(g) +Cl2(g)=2HCl(g) △H=-184.6kJ/mol SiO2 + 2C = Si+ 2CO↑ 原子
C + 4HNO3(浓)=4NO2 ↑+ CO2 ↑+2H2O 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- H2(g) +Cl2(g)=2HCl(g) △H=-184.6kJ/mol SiO2 + 2C = Si+ 2CO↑ 原子
【解析】
(1)A为短周期元素的金属单质,D为短周期元素的非金属单质,所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,可知A的最外层电子数小于4且为偶数,D位于第二周期,A位于第三周期,那么A为Mg,D为C;F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体为NO2,说明F为HNO3,C和浓HNO3反应生成CO2、NO2和H2O,B能和Mg反应生成C单质,即B为CO2,C为MgO,和浓HNO3反应生成Mg(NO3)2和水,E为Mg(NO3)2,据此作答;
(2)若A是常见的金属单质,D、F是气体单质,A为Fe,反应①在水溶液中进行,反应②也在水溶液中进行,那么B为酸,C为盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,因此F为Cl2,E为FeCl3,C为FeCl2,B为HCl,D为H2;
D为H2,F为Cl2,二者反应的方程式为:H2+Cl2=2HCl根据方程式计算反应热,并书写正确的热化学方程式;
(3)A、D、F都是短周期非金属元素的单质,且A、D所含元素同主族,A、F所含元素同周期,则A为C,B为SiO2,D为Si,F为O2,E为CO2,反应①为C与SiO2的反应。
(1)由分析可知A为Mg,原子结构示意图为:![]() ;反应④为C和浓HNO3反应,反应生成CO2、NO2和H2O,反应方程式为:C + 4HNO3(浓)=4NO2 ↑+ CO2 ↑+2H2O;
;反应④为C和浓HNO3反应,反应生成CO2、NO2和H2O,反应方程式为:C + 4HNO3(浓)=4NO2 ↑+ CO2 ↑+2H2O;
(2)C为FeCl2,F为Cl2,二者反应生成FeCl3,离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-;1molH2与1molCl2反应生成2molHCl,1gH2与Cl2反应放出92.3kJ热量,那么1molH2与Cl2反应放出的热量为92.3kJ×2=184.6kJ,因此热化学方程式为:H2(g) +Cl2(g)=2HCl(g) △H=-184.6kJ/mol
(3)A为C,B为SiO2,二者反应生成Si和CO,反应方程式为:SiO2 + 2C = Si+ 2CO↑,B为SiO2,属于原子晶体。

 阅读快车系列答案
阅读快车系列答案【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+![]() S↓+2I2+2H2O ii.I2+2H2O+SO2
S↓+2I2+2H2O ii.I2+2H2O+SO2![]() SO42- +4H++2I-
SO42- +4H++2I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
下列说法不正确的是( )
A. 水溶液中SO2歧化反应方程式为3SO2+2H2O ![]() 2H2SO4 +S↓
2H2SO4 +S↓
B. II是I的对比实验,则a=0.4
C. 比较I、II、III,可得出的结论是:I是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
D. 实验表明,SO2的歧化反应速率IV>I,原因是反应i比ii快;IV中由反应ii产生的H+使反应i加快