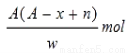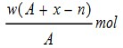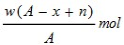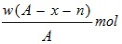题目内容
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
A.同周期的主族元素中,ⅦA族元素的原子半径最小
B.碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱
C.元素周期表中从ⅢB到ⅡB十个纵列的元素都是金属元素
D.ⅠA元素的原子,其半径越大,越容易失去电子
B
【解析】
试题分析:A.同周期的主族元素中,从左到右,随着原子序数的增大,原子半径逐渐减小。因此第ⅦA族元素的原子半径最小 。正确。B.同一主族的元素,从上到下,随着原子核外电子层数的增加,元素的金属性逐渐增强,非金属性逐渐减弱。碳族元素的C、Si是非金属元素,Ge、Sn、Pb是金属元素。错误。C.元素周期表中从ⅢB到ⅡB十个纵列的元素都是属于过渡元素,都是金属元素。正确。D.Ⅰ A元素的原子,从上到下。属于核外的电子层数逐渐增多,半径逐渐增大,原子失去电子的能力逐渐增强。即越容易失去电子。正确。
考点:考查同周期、同一主族的元素的原子半径、元素的金属性、非金属性的递变规律的知识。

 字词句段篇系列答案
字词句段篇系列答案(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③ a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。