题目内容
【题目】SiO2广泛存在于自然界中,其在工业生产中有着广泛的用途。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)==6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)==CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)==6CaSiO3(s)+P4(s)+10CO(g) ΔH3 则ΔH3=________ kJ·mol-1。
(2)工业上用石英砂和焦炭可制得粗硅。
已知:
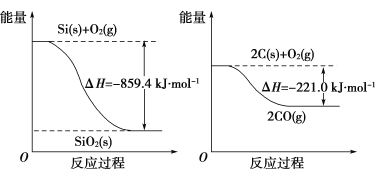
请将以下反应的热化学方程式补充完整:
SiO2(s)+2C(s)==Si(s)+2CO(g) ΔH=________。
【答案】(1)+2 821.6 (2)+638.4 kJ·mol-1
【解析】(1)根据反应2Ca3(PO4)2(s)+10C(s)==6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1 ①,CaO(s)+SiO2(s)==CaSiO3(s) ΔH2=-89.61 kJ·mol-1 ②,运用盖斯定律将①+②×6得:
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)==6CaSiO3(s)+P4(s)+10CO(g),则ΔH3=+3 359.26 kJ·mol-1-89.61 kJ·mol-1×6=+2 821.6 kJ·mol-1。(2)由题图可知Si(s)+O2(g)==SiO2(s) ΔH1=-859.4 kJ·mol-1,2C(s)+O2(g)==2CO(g) ΔH2=-221.0 kJ·mol-1,根据盖斯定律有:ΔH=ΔH2-ΔH1=+638.4 kJ·mol-1。
