题目内容
【题目】水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点.以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe﹣═NaLixV3O8 , 则下列说法不正确的是( ) 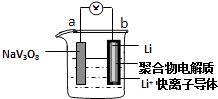
A.放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8
B.充电过程中Li+从阳极向阴极迁移
C.充电过程中阳极的电极反应式为NaLixV3O8﹣xe﹣═NaV3O8+xLi+ , NaLixV3O8中钒的化合价发生变化
D.该电池可以用硫酸钠溶液作电解质
【答案】D
【解析】解:放电时,b电极Li作负极,Li失电子发生氧化反应,电极反应式为Li﹣e﹣═Li+ , a作正极,电极反应式为NaV3O8+xLi++xe﹣=NaLixV3O8 , 则电池反应式为NaV3O8+xLi=NaLixV3O8 , 故A正确;B.充电时,阳离子向阴极移动、阴离子向阳极移动,所以Li+从阳极向阴极迁移,故B正确;
C.充电时,阴极、阳极电极反应式与负极、正极反应式正好相反,所以阳极的电极反应式为NaLixV3O8﹣xe﹣=NaV3O8+xLi+ , NaLixV3O8中Na、O、Li元素化合价不变,则钒的化合价发生变化,失电子发生氧化反应,故C正确;
D.Li极易和水反应生成LiOH和氢气,所以电池中不可以用硫酸钠溶液作电解质溶液,故D错误;
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

