题目内容
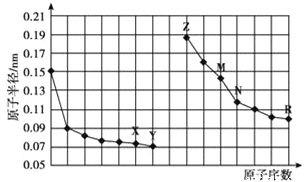
【题目】如图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
A.![]() 一定不与酸反应
一定不与酸反应
B.![]() 与水反应时,水是还原剂
与水反应时,水是还原剂
C.简单离子的半径:![]()
D.最高价氧化物对应水化物的碱性:![]()
【答案】C
【解析】
根据同周期自左而右原子半径减小,同主族自上而下原子半径增大,结合部分短周期元素原子半径与原子序数的关系图可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,结合元素周期律及物质性质分析作答。
根据部分短周期元素原子半径与原子序数的关系图可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素;
A.NX2为SiO2,SiO2可与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O,故A错误;
B.![]() 即
即![]() 与水反应时,
与水反应时,![]() 既是氧化剂又是还原剂,H2O既不是氧化剂又不是还原剂,故B错误;
既是氧化剂又是还原剂,H2O既不是氧化剂又不是还原剂,故B错误;
C.M、Z、X的离子依次为Al3+、Na+、O2-,三者具有相同的电子层结构,核电荷数越大离子半径越小,则离子半径Al3+<Na+<O2-,故C正确;
D. 同周期元素从左到右元素的金属性逐渐减弱,金属性越强,对应的最高价氧化物对应水化物的碱性越强,金属性:Na>Al,碱性:NaOH>Al(OH)3,故D错误;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示![]() 已知CuO可以作为碳氢化合物燃烧的催化剂
已知CuO可以作为碳氢化合物燃烧的催化剂![]() :
:

(1)若A装置中所盛放的药品是浓NaOH溶液,装置A的作用有:
①______;
②______
(2)D装置中所盛放的药品是______,
(3)E装置的作用是______,
(4)上述装置中有一处缺陷,请改正______.
(5)若实验装置经过改正后,得到的实验数据如下:
质量 | 实验前 | 实验后 |
药品 |
|
|
药品 |
|
|
则该气体中碳和氢两种元素的质量比为______.
【题目】下面两表分别列出了CO和![]() 的某些性质及相关键能,有关说法不正确的是
的某些性质及相关键能,有关说法不正确的是
表1:
分子 | 熔点 | 沸点 | 常温时在水 中溶解度 |
CO |
|
|
|
|
|
|
|
表2:
CO |
|
|
|
键能 |
|
| |
|
|
|
|
键能 | 193 | 418 | 946 |
A.CO与![]() 的价电子总数相等
的价电子总数相等
B.由表2可知,CO的活泼性不及![]()
C.由表1可知,CO的熔沸点高于![]() ,是因为CO分子间作用力大于
,是因为CO分子间作用力大于![]()
D.由表1可知,室温时,CO在水中的溶解性大于![]() ,是因为CO分子有弱极性
,是因为CO分子有弱极性
【题目】CO和![]() 的某些性质及相关键能如下表所示,下列说法不正确的是
的某些性质及相关键能如下表所示,下列说法不正确的是
表一
分子 | 熔点 | 沸点 | 常温时在水中的溶解度 |
CO |
|
|
|
|
|
|
|
表二
碳氮键 |
|
|
|
键能 |
|
|
|
氮氮键 |
|
|
|
键键能 | 193 | 418 | 946 |
A.CO与![]() 的价电子总数相等
的价电子总数相等
B.由表2可知,CO的活泼性不及![]() ,因为
,因为![]() 的键能大于
的键能大于![]()
C.由表1可知,CO的熔沸点高于![]() ,因为CO分子间作用力大于
,因为CO分子间作用力大于![]()
D.由表1可知,室温时CO在水中的溶解度大于![]() ,因为CO是极性分子
,因为CO是极性分子