ЬтФПФкШн
ЁОЬтФПЁПЙЄвЕЗЯЦјЁЂЦћГЕЮВЦјХХЗХГіЕФ SO2ЁЂNOxЕШЃЌЪЧаЮГЩЮэіВЕФживЊвђЫиЃЎіВЪЧгЩПеЦјжаЕФЛвГОЁЂСђЫсЁЂЯѕЫсЁЂгаЛњЬМЧтЛЏКЯЮяЕШСЃзгаЮГЩЕФбЬЮэЃЎ
ЃЈ1ЃЉNOxКЭ SO2дкПеЦјжаДцдкЯТСаЦНКтЃК
2NO(g) + O2(g)![]() 2NO2(g) Ёї H = 113.0kJ
2NO2(g) Ёї H = 113.0kJ![]() mol1
mol1
2SO2(g) + O2(g)![]() 2SO3(g) Ёї H = 196.6kJ
2SO3(g) Ёї H = 196.6kJ![]() mol1
mol1
SO2ЭЈГЃдкЖўбѕЛЏЕЊЕФДцдкЯТЃЌНјвЛВНБЛбѕЛЏЃЌЩњГЩ SO3ЃЎ
ЂйаДГі NO2КЭ SO2ЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊ_____ЃЎ
ЂкЫцЮТЖШЩ§ИпЃЌИУЗДгІЛЏбЇЦНКтГЃЪ§БфЛЏЧїЪЦЪЧ_____ЃЎ
ЃЈ2ЃЉЬсИп2SO2(g) + O2(g)![]() 2SO3(g)ЗДгІжа SO2ЕФзЊЛЏТЪЃЌЪЧМѕЩй SO2ХХЗХЕФгааЇДыЪЉ:ЂйT ЮТЖШЪБЃЌдк 1L ЕФУмБеШнЦїжаМгШы 2.0mol SO2КЭ 1.0mol O2ЃЌ5min КѓЗДгІДяЕНЦНКтЃЌЖўбѕЛЏСђЕФзЊЛЏТЪЮЊ 50%ЃЌИУЗДгІЕФЦНКтГЃЪ§ЪЧ_____ЃЎЂкдкЂйжаЬѕМўЯТЃЌЗДгІДяЕНЦНКтКѓЃЌИФБфЯТСаЬѕМўЃЌФмЪЙ SO2ЕФзЊЛЏТЪЬсИпЕФЪЧ_____(ЬюзжФИ)ЃЎ
2SO3(g)ЗДгІжа SO2ЕФзЊЛЏТЪЃЌЪЧМѕЩй SO2ХХЗХЕФгааЇДыЪЉ:ЂйT ЮТЖШЪБЃЌдк 1L ЕФУмБеШнЦїжаМгШы 2.0mol SO2КЭ 1.0mol O2ЃЌ5min КѓЗДгІДяЕНЦНКтЃЌЖўбѕЛЏСђЕФзЊЛЏТЪЮЊ 50%ЃЌИУЗДгІЕФЦНКтГЃЪ§ЪЧ_____ЃЎЂкдкЂйжаЬѕМўЯТЃЌЗДгІДяЕНЦНКтКѓЃЌИФБфЯТСаЬѕМўЃЌФмЪЙ SO2ЕФзЊЛЏТЪЬсИпЕФЪЧ_____(ЬюзжФИ)ЃЎ
a.ЮТЖШКЭШнЦїЬхЛ§ВЛБфЃЌГфШы 1.0mol He
b.ЮТЖШКЭШнЦїЬхЛ§ВЛБфЃЌГфШы 1.0mol O2
c.дкЦфЫћЬѕМўВЛБфЪБЃЌМѕЩйШнЦїЕФЬхЛ§
d.дкЦфЫћЬѕМўВЛБфЪБЃЌИФгУИпаЇДпЛЏМС
e.дкЦфЫћЬѕМўВЛБфЪБЃЌЩ§ИпЬхЯЕЮТЖШ

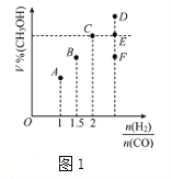
ЃЈ3ЃЉЙЄвЕЩЯРћгУТШМюЙЄвЕВњЦЗжЮРэКЌЖўбѕЛЏСђЕФЗЯЦјЃЎШчЭМЪЧТШМюЙЄвЕжаЕчНтБЅКЭЪГбЮЫЎЕФдРэЪОвтЭМ
ЂйгУШмвКAЮќЪеКЌЖўбѕЛЏСђЕФЗЯЦјЃЌЦфЗДгІЕФРызгЗНГЬЪНЪЧ_____ЃЎ
ЂкгУКЌЦјЬхBЕФбєМЋЧјШмвКЮќЪеКЌЖўбѕЛЏСђЕФЗЯЦјЃЌЦфЗДгІЕФРызгЗНГЬЪНЪЧ_____ЃЎ
ЁОД№АИЁПNO2(g)+SO2(g)=SO3(g)+NO(g) ЁїH=41.8kJmol1 МѕаЁ 2 bc SO2+OH-=HSO3-ЃЈЛђSO2+2OH-=SO32-+H2OЃЉ SO2+Cl2+H2O=4H++SO42-+2Cl-
ЁОНтЮіЁП
ЃЈ1ЃЉЂйNO2КЭSO2ЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКNO2(g)+SO2(g)=SO3(g)+NO(g)ЃЌИљОнИЧЫЙЖЈТЩПЩЕУЃКЃЈЂк-ЂйЃЉ/2ПЩЕУЦфЁїHЁЃ
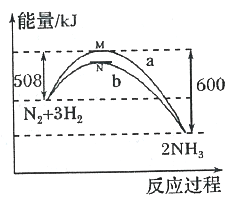
ЂкЖдгкЮќШШЗДгІЃЌЮТЖШЩ§ИпЃЌЦНКтГЃЪ§діДѓЃЌЖдгкЗХШШЗДгІЃЌЮТЖШЩ§ИпЃЌЦНКтГЃЪ§МѕаЁЁЃ
ЃЈ2ЃЉЂйИљОнШ§ЖЮЪНМЦЫуЦНКтГЃЪ§ЁЃ
Ђкa.ЮТЖШКЭШнЦїЬхЛ§ВЛБфЃЌГфШыЖшадЦјЬхЃЌЦНКтВЛвЦЖЏЃЌзЊЛЏТЪВЛБфЃЛ
b.ЮТЖШКЭШнЦїЬхЛ§ВЛБфЃЌдіМгЗДгІЮяХЈЖШЃЌЦНКте§ЯђвЦЖЏЃЌзЊЛЏТЪдіДѓЃЛ
c.МѕЩйШнЦїЕФЬхЛ§ЃЌЯрЕБгкдіДѓбЙЧПЃЌЦНКте§ЯђвЦЖЏЃЌзЊЛЏТЪЬсИпЃЛ
d.ДпЛЏМСжЛИФБфЗДгІЫйТЪЃЌВЛгАЯьзЊЛЏТЪЃЛ
e.ИУЗДгІе§ЗДгІЮЊЗХШШЗДгІЃЌЩ§ИпЬхЯЕЮТЖШЃЌЦНКтФцЯђвЦЖЏЃЌзЊЛЏТЪБфаЁЃЛ
ЃЈ3ЃЉЕчНтБЅКЭЪГбЮЫЎЃЌбєМЋЃК2Cl--2e-=Cl2ЁќЃЌвѕМЋЃК2H++2e-=H2ЁќЃЌзмЗДгІЮЊЃК2NaCl+2H2O![]() 2NaOH+Cl2Ёќ+H2ЁќЃЌЫљвдЦјЬхBЮЊТШЦјЃЌШмвКAЮЊЧтбѕЛЏФЦЁЃ
2NaOH+Cl2Ёќ+H2ЁќЃЌЫљвдЦјЬхBЮЊТШЦјЃЌШмвКAЮЊЧтбѕЛЏФЦЁЃ
ЃЈ1ЃЉЂйNO2КЭSO2ЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКNO2(g)+SO2(g)=SO3(g)+NO(g)ЃЌИљОнИЧЫЙЖЈТЩЃК(Ђк-Ђй)/2ЕУЃКЁїH =![]() ( 196.6kJ
( 196.6kJ![]() mol1+113.0kJ
mol1+113.0kJ![]() mol1)=41.8kJmol1ЃЌЦфШШЛЏбЇЗДгІЗНГЬЪНЮЊЃКNO2(g)+SO2(g)=SO3(g)+NO(g) ЁїH=41.8kJmol1ЃЌЙЪД№АИЮЊЃКNO2(g)+SO2(g)=SO3(g)+NO(g) ЁїH=41.8kJmol1ЁЃ
mol1)=41.8kJmol1ЃЌЦфШШЛЏбЇЗДгІЗНГЬЪНЮЊЃКNO2(g)+SO2(g)=SO3(g)+NO(g) ЁїH=41.8kJmol1ЃЌЙЪД№АИЮЊЃКNO2(g)+SO2(g)=SO3(g)+NO(g) ЁїH=41.8kJmol1ЁЃ
ЂкгЩЂйПЩжЊЃЌИУЗДгІЕФе§ЗДгІЮЊЗХШШЗДгІЃЌЫљвдЩ§ИпЮТЖШЃЌЦНКтЯђФцЯђвЦЖЏЃЌЦНКтГЃЪ§МѕаЁЃЌЙЪД№АИЮЊЃКМѕаЁЁЃ
ЃЈ2ЃЉЂй1LУмБеШнЦїжаЃЌ5minФкИїЮяжЪХЈЖШЗЂЩњЕФБфЛЏШчЯТЃК
2SO2(g)+O2(g)![]() 2SO3(g)ЃЌ
2SO3(g)ЃЌ
Ц№ЪМХЈЖШ(mol/L) 210
БфЛЏХЈЖШ(mol/L) 10.51
ЦНКтХЈЖШ(mol/L) 10.5 1
ЦНКтГЃЪ§ ЃЌЙЪД№АИЮЊЃК2ЁЃ
ЃЌЙЪД№АИЮЊЃК2ЁЃ
Ђкa.ЮТЖШКЭШнЦїЬхЛ§ВЛБфЃЌГфШы1.0molHeЃЌЦНКтВЛвЦЖЏЃЌSO2ЕФзЊЛЏТЪВЛБфЃЌaДэЮѓЃЛ
b.ЮТЖШКЭШнЦїЬхЛ§ВЛБфЃЌГфШы1.0molO2ЃЌЦНКте§ЯђвЦЖЏЃЌSO2ЕФзЊЛЏТЪЬсИпЃЌbе§ШЗЃЛ
c.дкЦфЫћЬѕМўВЛБфЃЌМѕЩйШнЦїЕФЬхЛ§ЃЌЯрЕБгкдіДѓбЙЧПЃЌЦНКте§ЯђвЦЖЏЃЌSO2ЕФзЊЛЏТЪЬсИпЃЌcе§ШЗЃЛ
d.дкЦфЫћЬѕМўВЛБфЪБЃЌИФгУИпаЇДпЛЏМСЃЌЦНКтВЛвЦЖЏЃЌSO2ЕФзЊЛЏТЪВЛБфЃЌdДэЮѓЃЛ
e.ИУЗДгІе§ЗДгІЮЊЗХШШЗДгІЃЌдкЦфЫћЬѕМўВЛБфЪБЃЌЩ§ИпЬхЯЕЮТЖШЃЌЦНКтФцЯђвЦЖЏЃЌSO2ЕФзЊЛЏТЪБфаЁЃЌeДэЮѓЃЛЙЪД№АИЮЊЃКbcЁЃ
ЃЈ3ЃЉЂйЕчНтБЅКЭЪГбЮЫЎЃЌбєМЋЃК2Cl--2e-=Cl2ЁќЃЌвѕМЋЃК2H++2e-=H2ЁќЃЌзмЗДгІЮЊЃК2NaCl+2H2O![]() 2NaOH+Cl2Ёќ+H2ЁќЃЌЦјЬхBЮЊТШЦјЃЌШмвКAЮЊЧтбѕЛЏФЦЁЃЧтбѕЛЏФЦгыЖўбѕЛЏСђЗДгІЃЌЦфЛЏбЇЗДгІЗНГЬЪНЮЊЃКSO2+NaOH= NaHSO3ЃЈЛђSO2+2NaOH=Na2SO3+H2OЃЉЃЌЦфРызгЗДгІЗНГЬЪНЮЊЃКSO2+OH-=HSO3-ЃЈЛђSO2+2OH-=SO32-+H2OЃЉЃЌЙЪД№АИЮЊЃКSO2+OH-=HSO3-ЃЈЛђSO2+2OH-=SO32-+H2OЃЉЃЛ
2NaOH+Cl2Ёќ+H2ЁќЃЌЦјЬхBЮЊТШЦјЃЌШмвКAЮЊЧтбѕЛЏФЦЁЃЧтбѕЛЏФЦгыЖўбѕЛЏСђЗДгІЃЌЦфЛЏбЇЗДгІЗНГЬЪНЮЊЃКSO2+NaOH= NaHSO3ЃЈЛђSO2+2NaOH=Na2SO3+H2OЃЉЃЌЦфРызгЗДгІЗНГЬЪНЮЊЃКSO2+OH-=HSO3-ЃЈЛђSO2+2OH-=SO32-+H2OЃЉЃЌЙЪД№АИЮЊЃКSO2+OH-=HSO3-ЃЈЛђSO2+2OH-=SO32-+H2OЃЉЃЛ
ЂкЦјЬхBЮЊТШЦјЃЌЦфШмвКгыЖўбѕЛЏСђЗЂЩњбѕЛЏЛЙдЗДгІЩњГЩСђЫсКЭбЮЫсЃЌЦфЛЏбЇЗДгІЗНГЬЪНЮЊЃКSO2+Cl2+2H2O=H2SO4+2HClЃЌЦфРызгЗДгІЗНГЬЪНЮЊЃКSO2+Cl2+H2O=4H++SO42-+2Cl-ЃЌЙЪД№АИЮЊЃКSO2+Cl2+H2O=4H++SO42-+2Cl-ЁЃ

 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИЁОЬтФПЁПКЌТШЛЏКЯЮядкЙЄХЉвЕЩњВњКЭШеГЃЩњЛюжагазХЙуЗКЕФгУЭОЁЃ
(1)ЙЄвЕЩЯгУТШЦјжЦБИЦЏАзЗлЃЌФГбаОПаЁзщРћгУЯТСазАжУжЦБИЦЏАзЗлЁЃ

ЂйЦЏАзЗлЕФгааЇГЩЗжЪЧ_____________ЃЈЬюЛЏбЇЪНЃЉЁЃЦЏАзЗлЗХжУдкПеЦјжавЛЖЮЪБМфКѓЛсЪЇаЇЃЌдвђЪЧЃЈаДГігаЙиЗДгІЕФЛЏбЇЗНГЬЪНЃЉ________________________ЁЃ
ЂкзАжУAжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________________________________ЁЃ
ЂлзАжУBжаЪдМСaЮЊ_________ЃЌзїгУЪЧ________________________________ЁЃ
(2)ClO2ГЃгУгкздРДЫЎЕФЯћЖОЁЂФОжЪжННЌЕФЦЏАзЁЃвбжЊЃКNaClЃЋ3H2O![]() NaClO3ЃЋ3H2ЁќЃЌ2NaClO3ЃЋ4HCl=2ClO2ЁќЃЋCl2ЁќЃЋ2NaClЃЋ2H2OЁЃгаЙиЮяжЪЕФШлЁЂЗаЕуШчЯТБэЃК
NaClO3ЃЋ3H2ЁќЃЌ2NaClO3ЃЋ4HCl=2ClO2ЁќЃЋCl2ЁќЃЋ2NaClЃЋ2H2OЁЃгаЙиЮяжЪЕФШлЁЂЗаЕуШчЯТБэЃК
ЮяжЪ | ШлЕу/Ёц | ЗаЕу/Ёц |
ClO2 | Ѓ59 | 11 |
Cl2 | Ѓ107 | Ѓ34.6 |
ClO2ЕФЩњВњСїГЬЪОвтЭМШчЯТЃК

РэТлЩЯУПЩњГЩ1molClO2ЃЌЭтНчжСЩйВЙГфXЦјЬх________ molЁЃДгClO2ЗЂЩњЦїжаЗжРыГіClO2ПЩВЩгУЕФЗНЗЈЪЧ____________ЁЃ