题目内容
向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的总物质的量和加入混合溶液B的体积关系如图所示:
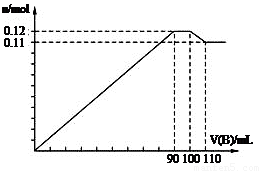
(1)当加入B溶液110 mL时,溶液中的沉淀是 。(填化学式)
(2)从90 mL至100 mL之间加入10 mLB溶液时,由图像纵坐标不变可知此段发生反应的离子方程式是:① ;② ;并由此可以分析出溶液B中Na2SO4与NaOH物质的量浓度之比为 。
(3)通过计算分析可知:
B溶液中NaOH物质的量浓度为 mol/L;
A溶液中FeCl3物质的量浓度为 mol/L。
(1)BaSO4、Fe(OH) 3(2分)
(2)①Ba2++SO42-== BaSO4↓(2分)
②Al(OH) 3+ OH-== AlO2-+2H2O (2分) 1:1(2分)
(3)c(NaOH)=" 1" mol/L(2分); c(FeCl3)=" 0.1" mol/L(2分)
【解析】
试题分析:(1)当加入B溶液110 mL时,有图可知道刚开始生的沉淀分别为)BaSO4、Fe(OH) 3、Al(OH) 3,由于Al(OH) 3是两性物质,其可以溶解与过量的氢氧化钠溶液,所以溶液中的沉淀是BaSO4、Fe(OH) 3;(2)从90 mL至100 mL之间加入10 mLB溶液时,由图像纵坐标不变可知此段发生反应的离子方程式是:①Ba2++SO42-== BaSO4↓②Al(OH) 3+ OH-== AlO2-+2H2O,有图可以看出溶液B中Na2SO4与NaOH物质的量浓度之比为1:1;(3)由图可以知道铝离子的物质的量为0.02mol(10mL刚好消耗0.01mol的沉淀),钡离子的物质的量为0.1mol(10mL刚好生成0.01mol的沉淀,从开始到100mL),铁离子的物质的量为0.01mol,所以B溶液中NaOH物质的量浓度为1 mol/L,而A溶液中FeCl3物质的量浓度为 0.1 mol/L。
考点:金属及其化合物
点评:本题考查了金属及其化合物,该考点是高考考查的重点和难点,本题要求学生要有一定的分析能力,该题有一定的难度。

 阅读快车系列答案
阅读快车系列答案


