题目内容
将ag Mg、Al合金完全溶解在V1L、c1mol/L的盐酸溶液中,产生bgH2。再向反应后的溶液中加入V2L,c2mol/LNaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。则下列关系式错误的是( )
| A.合金中的物质的量为(24b-a)/9mol |
| B.d=a+17b |
C.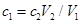 |
D.与金属反应后剩余盐酸的物质的量浓度为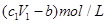 |
A、D
试题分析:A、设n(Mg)=xmol, n(Al)=ymol,
则有:24x+27y=a;x+1.5y=b/2
解之得:
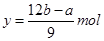


B、生成的沉淀的质量为氢氧化镁跟氢氧化铝的质量的和:也等于镁和铝的质量再加上氢氧根离子的质量,而氢氧根离子的质量在这里等于氢氧根离子的物质的量那氢氧根离子的摩尔质量之积,氢氧根离子的物质的量等于在这个反应过程中镁跟铝反应时所失去的电子的物质的量,又等于反应过程中酸中的氢所得到的电子的物质的量,也就是说氢氧根离子的物质的量等于氢气的物质的量的二倍。所以有如下关系:d=a+17b
C、在这个过程中后边加的氢氧化钠可以理解为是刚好跟前面加的盐酸进行中和反应。因此它们二者的物质的量相等,有:
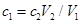
D、与金属反应后剩余盐酸的物质的量浓度为:
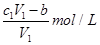

练习册系列答案
相关题目


 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”)