��Ŀ����
����Ŀ����������ϳɾ������½ṹ��������
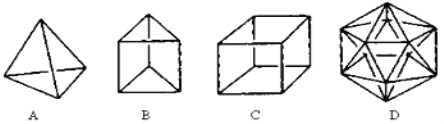
��1���ṹD��Ȼ�Dz����ܺϳɵģ�ԭ���� ��
��2���ڽṹA��ÿ����̼ԭ��֮�����һ��CH2ԭ���ţ������γɽ���顣������ķ���ʽΪ ��
��3��A��һ����״����ͬ���칹�������������Ȳ�ۺϵõ��������״���Ľṹ��ʽΪ ��
��4��B��һ��ͬ���칹������ķ���������֤���÷������е�̼̼�����ǵ�˫���������е���ʵ�� ��
a�����Ķ�λ��Ԫȡ����ֻ��һ��
b��������λ��Ԫȡ����ֻ��һ��
c������������̼̼���ļ��������
d���ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ
��5��C��һ�������¿ɷ���±����Ӧ����C�����ȴ��ﹲ�� ��ͬ���칹�塣
��6��C��һ�����ڷ�������ͬ���칹��������ij�����ϵĵ��壬��÷��������ӷ����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ�� ��
���𰸡���1��̼ԭ�Ӳ����γ�5�����ۼ� ��2�֣���2��C10H16��2�֣�
��3��CH2= CH��C��CH��2�֣�
��4��b c��5��3 ��2�֣�
��6��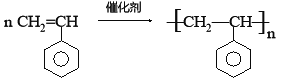
��������
�����������1��̼ԭ�������ֻ��4�����ӣ��ﵽ8�����ȶ��ṹʱ�����γ�4�����ۼ��������γ�5�����ۼ���
��2�����ݽṹ��֪���ɲ���6��CH2ԭ���ţ���CӦΪ10����HӦΪ6��2+4=16�����Է���ʽΪC10H16��
��3��A��һ����״����ͬ���칹�������������Ȳ�ۺϵõ����������Ȳ�Ľṹ��ʽ��֪����״���Ľṹ��ʽΪCH2= CH��C��CH��
��4����ķ�����ӦΪ������ѧ�����ǵ�˫�����棬����������̼̼���ļ�������ȣ�������λ��Ԫȡ����ֻ��һ�֣���֤���ýṹ�������������Ƿ�˫�����棬���Ķ�λ��Ԫȡ���ﶼֻ��һ�֣�����һ�������¶��ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ������֤����Ϊbc��
��5��C�����ȴ��������ȴ����ͬ���칹��������ͬ�����ȴ��������֣��������ڡ���Խ��ߺ���Խ��ߣ�����ͬ���칹�塣
��6��C��һ�����ڷ�������ͬ���칹��������ij���ϵĵ��壬ӦΪ����ϩ�������Ӿ۷�Ӧ�����۱���ϩ������ʽΪ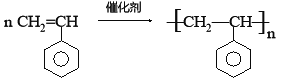 ��
��

 �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д� ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д�����Ŀ��Ϊ�˺������û�ѧ�ܣ�ȷ����ȫ���������������Ҫ��ֿ��ǻ�ѧ��Ӧ�ķ�Ӧ�ȣ�����ȡ��Ӧ��ʩ����ѧ��Ӧ�ķ�Ӧ��ͨ����ʵ����вⶨ��Ҳ�ɽ����������㡣
��1��ʵ���ã�5g�״���CH3OH��Һ���������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113.5kJ�����������ʾ�״���ȼ���ȵ��Ȼ�ѧ����ʽΪ�� ��
��2���������������Ȼ�ѧ����ʽ����a b����������������������������
H2(g)+ 1/2O2(g)��H2O(g) ��H1��a kJ��mol-1
H2(g)+ 1/2O2(g)��H2O(l) ��H2��b kJ��mol-1
��3����1mol��̬������ij�ֹ��ۼ���Ҫ���յ������м��ܡ��ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̡��ڻ�ѧ��Ӧ�����У���ѧ����Ҫ�����������γɻ�ѧ���ֻ��ͷ�������
��ѧ�� | H��H | N��H | N��N |
����/kJ��mol��1 | 436 | 391 | 945 |
��֪��ӦN2(g)��3H2(g)![]() 2NH3(g) ��H��a kJ��mol��1���Ը��ݱ������м������ݹ���a��ֵ��_______________(ע����+����������)��
2NH3(g) ��H��a kJ��mol��1���Ը��ݱ������м������ݹ���a��ֵ��_______________(ע����+����������)��
��4�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ�ķ�Ӧ�Ƚ������㡣����ˮú���ϳɶ����ѵ�������Ӧ���£�
�� 2H2(g) + CO(g)![]() CH3OH(g)����H ����90.8 kJ��mol��1
CH3OH(g)����H ����90.8 kJ��mol��1
�� 2CH3OH(g)![]() CH3OCH3(g) + H2O(g)����H����23.5 kJ��mol��1
CH3OCH3(g) + H2O(g)����H����23.5 kJ��mol��1
�� CO(g) + H2O(g)![]() CO2(g) + H2(g)����H����41.3 kJ��mol��1
CO2(g) + H2(g)����H����41.3 kJ��mol��1
�ܷ�Ӧ��3H2(g) + 3CO(g)![]() CH3OCH3(g) + CO2(g)����H�� ��
CH3OCH3(g) + CO2(g)����H�� ��

