题目内容
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应: 3A(s)+2B(g)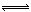 4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
A.前2min,D的平均反应速率为0.2mol·L-1·min-1。
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动,化学平衡常数不变
D.增加B,平衡向右移动,B的平衡转化率增大
【答案】
B
【解析】
试题分析:前2min,D的平均反应速率为1.6/4/2L/2min=0.1mol·L-1·min-1,故选项A错误;B的平衡转化率是1.6/4*2/2*100%=40%,B选项正确;增大该体系的压强,根据勒夏特列定律,平衡向逆反应方向进行,化学平衡常数不变,选项C错误;增加B,平衡向右移动,但一定温度下,化学平衡常数不变,B的平衡转化率不变,选项D错误。
考点:化学平衡
点评:化学反应平均反应速率的计算,应注意不要忽略容器体积;一定温度下,化学反应平衡常数不变;化学平衡遵循勒夏特列定律:如果改变影响平衡的一个条件(如温度,压强等),平衡就向能够减弱这种改变的方向移动。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目