题目内容
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.这四种离子的电子层结构相同,因而离子的性质也就相同
B.原子序数:b>a>c>d
C.最高价氧化物对应水化物的碱性:B>A
D.气态氢化物的稳定性:D>C
B
解析试题分析:A、这四种离子的电子层结构相同,但离子的性质还与离子的核电荷数有关,错误; B、原子中核电荷数等于核外电子数,阳离子中核外电子数等于核电荷数减去离子所带电荷数,阴离子中核外电子数等于核电荷数加上离子所带电荷数。aAn+、bB(n+1)+、cCn-、dD(n+1)-电子层结构相同,有如下关系: a-n=b-(n+1)=c+n=d+n+1,故b>a>c>d,正确;C、因b>a故在周期表中B的位置在A的后边,B的金属性比A的弱,最高价氧化物对应水化物的碱性: A>B,错误;D、因c>d故在周期表中C的位置在D的后边,C的非金属性比D的强,气态氢化物的稳定性C>D,错误。
考点:元素的原子结构与元素周期律的关系。

练习册系列答案
相关题目
对发现元素周期律贡献最大的化学家是 ( )
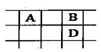
| A.牛顿 | B.道尔顿 | C.阿伏加德罗 | D.门捷列夫 |
下列各组原子中,化学性质一定相似的是
| A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子 |
| C.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子 |
| D.最外层都只有一个电子的X、Y原子 |
电子层数相同的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性由强到弱顺序为:HXO4>H2YO4>H3ZO4,下列判断错误的是
| A.原子半径 X>Y>Z | B.气态氢化物稳定性X>Y>Z |
| C.元素原子得电子能力X>Y>Z | D.单质与氢气反应难易X>Y>Z |
下列判断中一定正确的是
| A.若X、Y都是气态氢化物,且相对分子质量:X﹥Y,则沸点:X﹥Y |
| B.若X、Y属于同主族元素,且相对原子质量:X﹥Y,则X的失电子能力比Y强 |
| C.若R2-和M+的电子层结构相同,则原子序数:R﹥M |
| D.若M、N是同主族元素,且原子序数:M﹥N,则非金属性:M﹥N |
对发现元素周期律贡献最大的化学家是 ( )
| A.牛顿 | B.道尔顿 | C.阿伏加德罗 | D.门捷列夫 |
下列化学用语表示正确的是
| A.原子核中有6个中子的硼原子:6 B | B.HCl的电子式: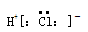 |
C.K+结构示意图: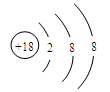 | D.HClO的结构式:H—O—Cl |