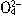题目内容
某溶液中含有:①HCO3-、②SO42-、③SO32-、④NO2- 等四种阴离子,向其中加入足量Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是
- A.①、④
- B.④
- C.②
- D.以上答案均不正确
B
分析:过氧化钠能和水反应生成氢氧化钠溶液和氧气,氧气能氧化亚硫酸根离子,氢氧化钠能和碳酸氢根离子反应生成碳酸根离子.
解答:过氧化钠能和水反应生成氢氧化钠溶液和氧气,氧气能将亚硫酸根氧化成为硫酸根,所以亚硫酸根浓度减小,硫酸根浓度增大,氢氧化钠能和碳酸氢根反应生成碳酸根,所以碳酸氢根浓度减小.
故选B.
点评:本题主要考查离子之间的反应以及离子共存的条件,难度不大.
分析:过氧化钠能和水反应生成氢氧化钠溶液和氧气,氧气能氧化亚硫酸根离子,氢氧化钠能和碳酸氢根离子反应生成碳酸根离子.
解答:过氧化钠能和水反应生成氢氧化钠溶液和氧气,氧气能将亚硫酸根氧化成为硫酸根,所以亚硫酸根浓度减小,硫酸根浓度增大,氢氧化钠能和碳酸氢根反应生成碳酸根,所以碳酸氢根浓度减小.
故选B.
点评:本题主要考查离子之间的反应以及离子共存的条件,难度不大.

练习册系列答案
相关题目
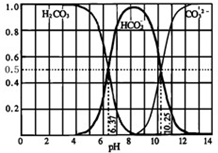
 (3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
(3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.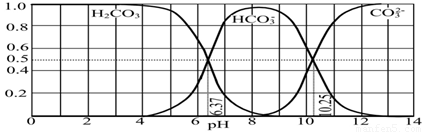
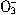 B.Cl- C.N
B.Cl- C.N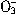 D.S
D.S