��Ŀ����
��1����������HA��H2B��HC�����볣��Ϊ1.8��10��5��5.6��10��11��4.9��10��10��4.3��10��7(����˳���Ѵ���)����֪����������ǵ���֮���ܷ������·�Ӧ��
��HA+HB��(����)��A��+H2B ��H2B(����)+C����HB��+HC
��HA(����)+C����A��+HC
��H2B��Ka1��4.3��10��7�������������Ӧ�ĵ��볣���ֱ�Ϊ(������֪������
��)��HA��Ka�� ��HC��Ka�� ��
��2��25 ��ʱ0.1 mol��L-1��H2Rˮ��Һ�У�������������������ҺpH���õ�����H2R��
HR����R2������������Һ����c(Na+)=c(R2��)+c(HR��)+c(H2R)ʱ��Һ������
Ϊ (�ѧʽ)��
��3����ͼ��ijˮ��Һ��pH��0��14�ķ�Χ��H2CO3��HCO3����CO32�����ֳɷ�ƽ��ʱ����ɷ�����
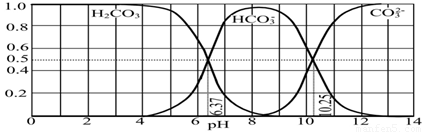
������������ȷ���� ��
A����ͼ��1.0 mol��L��1̼������Һ�ζ�1.0 mol��L��1 HCl��Һ�ĵζ�����
B����pH�ֱ�Ϊ6.37��10.25ʱ����Һ��c(H2CO3)=c(HCO3��)=c(CO32��)
C������ѪҺ��pHԼΪ7.4����CO2��ѪҺ�ж���HCO3����ʽ����
D������CO2��NaOH��Ӧ��ȡNaHCO3���˿�����Һ��pHΪ7��9֮��
����֪Ksp(CaCO3)=5.0��10��9����10 mL 0.02 mol��L��1��Na2CO3��Һ�У�����ijŨ�ȵ����ᣬ������Һ��pH=10.25����ʱ��Һ�����ǡ��Ϊ100 mL�������Һ�м���1 mL 1��10��4 mol��L��1��CaCl2��Һ�����Ƿ��г������ɣ� (��ǡ���)��
��1��HA��Ka��1.8��10��5��1�֣��� HC��Ka��4.9��10��10��1�֣�
��2��NaHR��2�֣�
��3�� �� C��D��2�֣� �� ��2�֣�
��������
�����������1���ɢٵó�����HAǿ��H2B���ɢڵ�H2Bǿ��HC���ɢ۵�HAǿ��HC��HA��ǿƽ�ⳣ�����2���ù�ϵʽΪNaHR�������غ㣻��3����A��ͼ��ʼΪH2CO3����̼������ӣ�����B����pH�ֱ�Ϊ6.37 ʱc(H2CO3)=c(HCO3��)�� pHΪ10.25ʱ����Һ��c(HCO3��)=c(CO32��)������C����ȷ��D��ͼ������ʾpHΪ7��9֮����Һ��Ҫ��HCO3��Ϊ������ȷ���ڴ�ʱ��Һ��c(CO32��)=0.02��0.01��0.1��0.5=0.001mol/L��c(Ca2+)=1��10��4��100=10��6 mol/L��Q=10��6��0.001=10��9��5.0��10��9����û�г������ɡ�
���㣺�������ƽ�⡢ˮ��ƽ�⡢�����ܽ�ƽ���й����⡣

��16�֣�I����1����������HA��H2B��HC������ƽ�ⳣ������ֵΪ1.8��10-5��5.6��10-11��4.9��10-10��4.3��10-7(����˳���Ѵ���)����֪����������ǵ���֮���ܷ������·�Ӧ����HA+ HB- (����)=A_ + H2B ,��H2B(����) + C- = HB_+ HC ,��HA(����) + C- =A_+ HC �����������Ӧ�ĵ���ƽ�ⳣ���ֱ�Ϊ������գ�
|
| HA | H2B | HC | |
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| ��ֵ |
|
|
|
|
��2��������0.1mol/LCH3COOH��Һ��ˮϡ���̣����б���ʽ����һ����С��:_______
A c��H+�� B c��H+��/c��CH3COOH�� C c��H+����c��OH-��
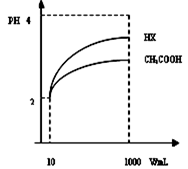
D c��OH-��/��H+�����Ϊ10mLpH=2������Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX����ƽ�ⳣ��_____������ڡ����ڻ�С�ڣ�����ƽ�ⳣ����������___________________________
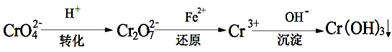
II����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����弰��̬ϵͳ�����ܴ���˺���������д�������ԭ�������dz��õ�һ�ַ�����
��1��ת�������д���ƽ��2CrO42- + 2H+ Cr2O72- +H2O��˵����Ӧ����ƽ��״̬����
A��CrO42- ��Cr2O72-��Ũ����ͬ B��2�ͣ�Cr2O72-��=�ͣ�CrO42-��
C����Һ��pHֵ���ֲ��� D����Һ��ɫ���ֲ���
��2����1Lת����������Һ�к���Ԫ������Ϊ28.6g��CrO42-��10/11ת��ΪCr2O72-����֪��Ԫ�����ԭ������Ϊ52������ת����������Һ��c(Cr2O72-)=
����֪�������¸÷�Ӧ��ƽ�ⳣ��K=1014,����ת����������Һ��pHΪ
��3����ԭ�����е����ӷ�Ӧ����ʽ
��4����������Ksp(Cr(OH)3)=10-32,Ҫʹc(Cr3+)����10-5mol/L����Һ��pHӦ����
��16�֣�I����1����������HA��H2B��HC������ƽ�ⳣ������ֵΪ1.8��10-5��5.6��10-11��4.9��10-10��4.3��10-7(����˳���Ѵ���)����֪����������ǵ���֮���ܷ������·�Ӧ����HA + HB- (����)=A_ + H2B ,��H2B(����) + C- = HB_ + HC ,��HA(����) + C- =A_ + HC �����������Ӧ�ĵ���ƽ�ⳣ���ֱ�Ϊ������գ�
| | HA | H2B | HC | |
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| ��ֵ | | | | |
A c��H+�� B c��H+��/c��CH3COOH�� C c��H+����c��OH-��
D c��OH-��/��H+�����Ϊ10mLpH=2������Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX����ƽ�ⳣ��_____������ڡ����ڻ�С�ڣ�����ƽ�ⳣ����������___________________________
II����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����弰��̬ϵͳ�����ܴ���˺���������д�������ԭ�������dz��õ�һ�ַ�����
��1��ת�������д���ƽ��2CrO42- + 2H+
 Cr2O72- + H2O��˵����Ӧ����ƽ��״̬����
Cr2O72- + H2O��˵����Ӧ����ƽ��״̬����A��CrO42-��Cr2O72-��Ũ����ͬ B��2�ͣ�Cr2O72-��=�ͣ�CrO42-��
C����Һ��pHֵ���ֲ��� D����Һ��ɫ���ֲ���
��2����1Lת����������Һ�к���Ԫ������Ϊ28.6g��CrO42-��10/11ת��ΪCr2O72-����֪��Ԫ�����ԭ������Ϊ52������ת����������Һ��c(Cr2O72-)=
����֪�������¸÷�Ӧ��ƽ�ⳣ��K=1014,����ת����������Һ��pHΪ
��3����ԭ�����е����ӷ�Ӧ����ʽ
��4����������Ksp(Cr(OH)3)=10-32,Ҫʹc(Cr3+)����10-5mol/L����Һ��pHӦ����
��16�֣�I����1����������HA��H2B��HC������ƽ�ⳣ������ֵΪ1.8��10-5��5.6��10-11��4.9��10-10��4.3��10-7(����˳���Ѵ���)����֪����������ǵ���֮���ܷ������·�Ӧ����HA + HB- (����)=A_ + H2B ,��H2B(����) + C- = HB_ + HC ,��HA(����) + C- =A_ + HC �����������Ӧ�ĵ���ƽ�ⳣ���ֱ�Ϊ������գ�
|
|
HA |
H2B |
HC |
|
|
Ka |
Ka1 |
Ka2 |
Ka3 |
Ka4 |
|
��ֵ |
|
|
|
|
��2��������0.1mol/LCH3COOH��Һ��ˮϡ���̣����б���ʽ����һ����С��:_______
A c��H+�� B c��H+��/c��CH3COOH�� C c��H+����c��OH-��
D c��OH-��/��H+�����Ϊ10mLpH=2������Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX����ƽ�ⳣ��_____������ڡ����ڻ�С�ڣ�����ƽ�ⳣ����������___________________________

II����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����弰��̬ϵͳ�����ܴ���˺���������д�������ԭ�������dz��õ�һ�ַ�����
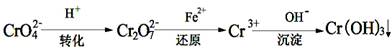
��1��ת�������д���ƽ��2CrO42- + 2H+  Cr2O72- +
H2O��˵����Ӧ����ƽ��״̬����
Cr2O72- +
H2O��˵����Ӧ����ƽ��״̬����
A��CrO42- ��Cr2O72-��Ũ����ͬ B��2�ͣ�Cr2O72-��=�ͣ�CrO42-��
C����Һ��pHֵ���ֲ��� D����Һ��ɫ���ֲ���
��2����1Lת����������Һ�к���Ԫ������Ϊ28.6g��CrO42-��10/11ת��ΪCr2O72-����֪��Ԫ�����ԭ������Ϊ52������ת����������Һ��c(Cr2O72-)=
����֪�������¸÷�Ӧ��ƽ�ⳣ��K=1014,����ת����������Һ��pHΪ
��3����ԭ�����е����ӷ�Ӧ����ʽ
��4����������Ksp(Cr(OH)3)=10-32,Ҫʹc(Cr3+)����10-5mol/L����Һ��pHӦ����
 ��3����ͼ��ijˮ��Һ��pH��0��14�ķ�Χ��H2CO3��HCO3-��CO32-���ֳɷ�ƽ��ʱ����ɷ�����
��3����ͼ��ijˮ��Һ��pH��0��14�ķ�Χ��H2CO3��HCO3-��CO32-���ֳɷ�ƽ��ʱ����ɷ�����