题目内容
【题目】磷及其化合物与人们的健康和生产生活密切相关。请回答下列问题:
(1)基态磷原子价电子轨道表示式为___________,其第一电离能比硫的___________(填“大”或“小”)。
(2).羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为___________,PO43-的空间构型为___________,该化合物所含元素电负性最大的是___________。
(3)P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键数目是___________。
(4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为___________,其为___________元酸,原因是___________。
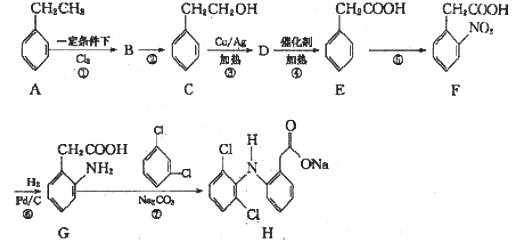
(5)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如下图所示:
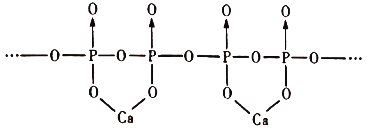
由图推知该多磷酸钙盐的通式为___________。
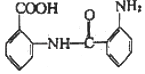
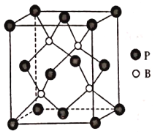
(6)磷化硼是一种超硬耐磨涂层材料,晶胞如下图所示,其密度为ρg/cm3,设NA是阿伏加德罗常数的值,则磷原子的配位数为___________,晶胞参数为___________pm。
【答案】 大 sp3 正四面体形 O(或氧元素) 12
大 sp3 正四面体形 O(或氧元素) 12  二 一个H3PO3分子中只有两个羟基,含氧酸羟基上的氢易电离 (CaP2O6)n 4
二 一个H3PO3分子中只有两个羟基,含氧酸羟基上的氢易电离 (CaP2O6)n 4 ![]() ×1010
×1010
【解析】
(1)根据P原子核外电子排布式确定其价层电子的轨道表示式;结合原子核外电子排布确定P与S第一电离能的大小;
(2)根据-OH中氧原子的价层电子对数判断氧原子杂化方式;根据价层电子对互斥理论确定其空间构型,根据元素的非金属性越强,元素的的电负性越大分析;
(3)根据P4O6中每个原子的最外层都满足8电子稳定结构,结合分子中各种元素的原子结构、原子个数分析;
(4)只有-OH中的H能电离,可以与碱反应,根据酸反应产生盐的种类数目确定-OH个数,进而得到酸的元数,结合P最外层电子数及形成微粒的稳定性判断其结构;
(5)根据多磷酸钙的结构简式分析其结构;
(6)根据白色球与周围最近的4个黑色球形成正四面体,确定配位数;用均摊法计算晶胞中各原子数目,来确定晶胞质量,再根据晶体密度=晶胞质量÷晶胞体积,晶胞体积等于边长的立方,计算晶胞参数。
(1) P是15号元素,原子核外电子排布式为1s22s22p63s23p3,其价电子排布式为3s23p3,所以基态磷原子价电子轨道表示式为 ;由于其最外层的3p能级电子处于半充满的稳定状态,所以失去一个电子比16号元素S难,需要的能量高,故其第一电离能比硫的大;
;由于其最外层的3p能级电子处于半充满的稳定状态,所以失去一个电子比16号元素S难,需要的能量高,故其第一电离能比硫的大;
(2)-OH中氧原子的价层电子对数为![]() ,所以氧原子按sp3方式杂化;PO43-中P原子价层电子对数=4+
,所以氧原子按sp3方式杂化;PO43-中P原子价层电子对数=4+![]() ,没有孤电子对,故PO43-为正四面体结构;根据元素的非金属性越强,元素的的电负性越大, Ca、P、O、H四种元素中O的非金属性最强,O元素的的电负性最大;
,没有孤电子对,故PO43-为正四面体结构;根据元素的非金属性越强,元素的的电负性越大, Ca、P、O、H四种元素中O的非金属性最强,O元素的的电负性最大;
(3)P原子最外层有5个电子,能够与3个O原子形成3对共用电子对,O原子最外层有6个电子,可以与2个P原子形成2对共用电子对,要使分子中每个原子都达到8电子稳定结构,其结构式为 ,可见分子中含有的共价键为12个;
,可见分子中含有的共价键为12个;
(4)亚磷酸与NaOH溶液发生酸碱中和反应只生成NaHPO3和NaH2PO3两种盐,羟基H原子能电离产生H+,说明H3PO3分子中含有2个-OH,它属于二元酸,由于P最外层有5个电子,则的结构式为 ;
;
(5)由图推知该多磷酸钙盐最小的重复单元是CaP2O6,所以该多磷酸钙盐的通式为(CaP2O6)n;
(6)根据晶体结构可知每个B原子被四个距离相等且最近的P原子包围,每个P原子被四个距离相等且最近的B原子包围,所以P原子的配位数是4;在一个晶胞中含有的P原子数目:![]() ,在一个晶胞中含有的B原子数目:4×1=4,即1个晶胞中含有4个BP,晶胞的质量是m=
,在一个晶胞中含有的B原子数目:4×1=4,即1个晶胞中含有4个BP,晶胞的质量是m=![]() g,由于晶胞密度为ρg/cm3,所以晶胞的体积为
g,由于晶胞密度为ρg/cm3,所以晶胞的体积为 cm3,所以晶胞参数为
cm3,所以晶胞参数为![]() cm=
cm=![]() ×1010pm。
×1010pm。

【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为:________。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团:_______________________。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式_____________。 | |