题目内容
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4,利用如图所示的实验装置进行实验。
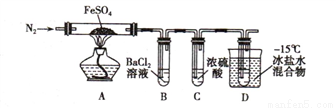
已知:①SO2熔点为-72℃,沸点为-10℃ ② SO3熔点为-16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是_________________________
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为_________色,写出该反应的化学方程式___________________。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是__________________, 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是 _______________
实验二 探究高温分解 FeSO4生成的气体
(4)用如图所示装置设计实验,验证高温分解FeSO4生成的气态物质
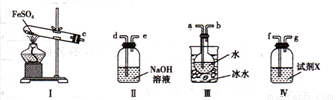
①按气流方向连接各仪器,用字母表示接口的连接顺序:c-__________________________
②试剂X的名称是 ___________________________
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。若最终得到沉淀的质量为Wg ,则已分解的FeSO4的质量 ________________g。
(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15, 则此时 V正_____ V逆(填“ > ”、“=”或“<”)。
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是______________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_________________。

(3)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下, 将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________。
(Ⅱ)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系_________________________ ;
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25mol·L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色。第二份溶液滴加0.10 mol·L-1 酸性KMnO4溶液至16mL时反应完全。则原试样中H2C2O4·2H2O的的质量分数为_______ 。


 CH3OH(g)
CH3OH(g) 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量