题目内容
【题目】资料显示:“氨气可在纯氧中安静燃烧…”.某校化学小组学生设计如下(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验. 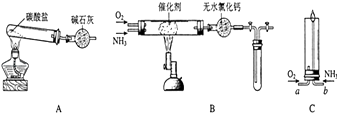
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是;碱石灰的作用是 .
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是 .
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是;其理由是 .
②氨气燃烧的化学方程式是 .
【答案】
(1)(NH4)2CO3或NH4HCO3;吸收CO2和H2O,得到纯净的NH3
(2)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(3)先通入O2 , 后通入NH3;若先通入NH3 , NH3在空气中不能点燃,NH3逸出会造成污染;4NH3+3O2 ![]() ?2N2+6H2O
?2N2+6H2O
【解析】解:(1)碳酸铵、碳酸氢铵不稳定受热分解生成氨气,据此可以用(NH4)2CO3或NH4HCO3加热制备氨气;氨气为碱性气体,应选择碱性干燥剂,碱石灰主要成分为氢氧化钠和氧化钙,为碱性干燥剂,可干燥氨气吸收生成的二氧化碳;故答案为:(NH4)2CO3或NH4HCO3;吸收CO2和H2O,得到纯净的NH3;(2)氨气催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2 ![]() 4NO+6H2O;故答案为:4NH3+5O2
4NO+6H2O;故答案为:4NH3+5O2 ![]() 4NO+6H2O;(3)①要点燃NH3 , 须先通入O2 , 后通入NH3 , 因为若先通入NH3 , NH3在空气中不能点燃,NH3逸出会造成污染;故答案为:先通入O2 , 后通入NH3;若先通入NH3 , NH3在空气中不能点燃,NH3逸出会造成污染;②氨气在氧气中燃烧生成氮气和水,方程式:4NH3+3O2
4NO+6H2O;(3)①要点燃NH3 , 须先通入O2 , 后通入NH3 , 因为若先通入NH3 , NH3在空气中不能点燃,NH3逸出会造成污染;故答案为:先通入O2 , 后通入NH3;若先通入NH3 , NH3在空气中不能点燃,NH3逸出会造成污染;②氨气在氧气中燃烧生成氮气和水,方程式:4NH3+3O2 ![]() 2N2+6H2O;故答案为:4NH3+3O2
2N2+6H2O;故答案为:4NH3+3O2 ![]() 2N2+6H2O.
2N2+6H2O.
(1)依据碳酸铵、碳酸氢铵不稳定受热分解生成氨气的性质解答;氨气为碱性气体,应选择碱性干燥剂,结合碱石灰的成分及性质解答;(2)氨气催化氧化生成一氧化氮和水;(3)①若先通入NH3 , NH3在空气中不能点燃,氨气可在纯氧中安静燃烧,依次进行判断;②NH3中N元素的化合价为﹣3价,为最低价态,具有还原性,在点燃条件下生成N2和水.

【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2 =5.6×10-6 |
回答下列问题:
(1)浓度均为0.1 molL-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是_____________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的第二级电离方程式为________________。Na2HPO3是_____________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1 molL-1的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是______(填字母)。
A.c(H+) B.  C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2 mol L-1的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_______________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是____________________________。

