题目内容
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
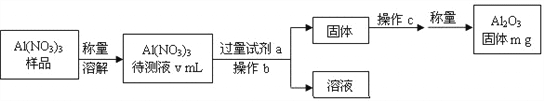
①加入过量试剂a,发生反应的离子方程式为___________________________。
②生成氧化铝的化学反应方程式是_______________________________________。
③Al(NO3)3待测液中,c (Al3+) = ______mol·L-1(用m、v表示)。
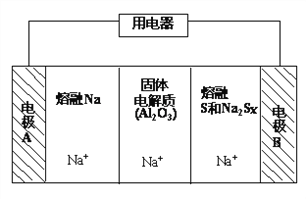
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①据下表数据,请你判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
a .100℃以下 b . 300℃~ 350℃ c. 100℃~ 300℃ d. 350℃~ 2050℃
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
②该电池工作时,2Na + xS(3<x<5)=Na2Sx,则电极A上发生的电极反应式是_______。
内电路中Na+的移动方向为_________(填“从A到B”或“从B到A”)。
【答案】 Al3++3NH3·H2O=Al(OH)3+3NH4+ 2Al(OH)3=Al2O3+H2O(加热) 1000m/51V b Na-e-=Na+ 从A到B
【解析】(1)分析实验流程可知,将样品配制成溶液后,加入过量的氨水与其反应生成氢氧化铝沉淀,然后过滤、洗涤得到氢氧化铝,最后把沉淀加热分解得到了氧化铝。
①加入过量试剂a,发生反应的离子方程式为Al3++3NH3·H2O=Al(OH)3+3NH4+ 。
②生成氧化铝的化学反应方程式是2Al(OH)3 ![]() Al2O3+H2O 。
Al2O3+H2O 。
③由氧化铝的质量可以求出n(Al2O3)= ![]() =
=![]() mol,由铝元素守恒可以求出n(Al3+)=
mol,由铝元素守恒可以求出n(Al3+)=![]() mol,所以Al(NO3)3待测液中c(Al3+) =
mol,所以Al(NO3)3待测液中c(Al3+) =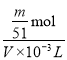 =
=![]() mol·L-1。
mol·L-1。
(2)①由表中钠和硫的熔、沸点数据,可以判断该电池工作的适宜温度应控制在115℃~444.6℃范围内,以保证钠和硫牌熔融状态、且不转化为气态,所以选b较为合适。
②该电池工作时,2Na + xS(3<x<5)=Na2Sx,电极A与熔融钠接触,所以A电极为负极,发生的电极反应式是Na-e-=Na+。原电池中阳离子一般向正极移动、阴离子向负极移动,由于氧化铝陶瓷只传导钠离子,所以内电路中Na+的移动方向为从A到B。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案