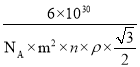题目内容
【题目】过氧化钙(CaO2)是一种难溶于水、溶于酸的白色固体,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。

回答下列问题:
(1)下图是某学生的过滤操作示意图,其操作不规范的是____。

a.漏斗末端颈尖未紧靠烧杯壁
b.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
c.将滤纸湿润,使其紧贴漏斗壁
d.玻璃棒用作引流
(2)步骤②需要在冰浴下进行,原因是_______。
(3)步骤③检验 CaO2· 8H2O是否洗净的方法是:取最后一次洗涤液少许于试管中,_______。
(4)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的缺点是_______。
(5)写出②发生的化学方程式_______。
(6)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2 含量的装置(夹持装置省略)。

若所取产品质量是 m g,测得气体体积为 V mL(已换算成标准状况),则产品中CaO2的质量分数为_______(用字母表示)。
【答案】 ab 防止过氧化氢分解,有利于产物析出(写出一条即可) 加入硝酸银溶液,若无白色沉淀产生,则洗涤干净,否则就没有洗涤干净 煅烧石灰石需要消耗大量的能量,成本高;产品纯度不高 CaCl2+2NH3H2O+H2O2=CaO2↓+2NH4Cl+2H2O或CaCl2+2NH3H2O+H2O2+6H2O=CaO28H2O↓+2NH4Cl 4.5V/7m%或9V/1400m×100%或9V/14m%
【解析】碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,煮沸过滤后得到氯化钙溶液,然后加入氨水和双氧水的混合溶液发生反应生成过氧化钙,过滤得到过氧化钙晶体,在氧气流中加热生成过氧化钙,据此解答。
(1)a.根据示意图可判断漏斗末端颈尖未紧靠烧杯壁,a错误;b.玻璃棒在漏斗中轻轻搅动会损坏滤纸,过滤时不能搅动,b错误;c.过滤时需要将滤纸湿润,使其紧贴漏斗壁,c正确;d.过滤时玻璃棒的作用是引流,d正确。答案选ab;
(2)双氧水受热易分解,且过氧化钙难溶于水,因此步骤②需要在冰浴下进行的原因是防止过氧化氢分解,同时也有利于产物析出。
(3)溶液中含有氯离子,得到的晶体表面有吸附的氯离子,则步骤③检验CaO2·8H2O是否洗净的方法是:取最后一次洗涤液少许于试管中,加入硝酸银溶液,若无白色沉淀产生,则洗涤干净,否则就没有洗涤干净。
(4)由于煅烧石灰石需要消耗大量的能量,成本高,且生成物中含有杂质,导致产品纯度不高。
(5)反应②是氯化钙与氨水、双氧水的混合液反应生成氯化铵和过氧化钙,则发生的化学反应方程式为CaCl2+2NH3H2O+H2O2=CaO2↓+2NH4Cl+2H2O。
(6)生成氧气的物质的量是![]() ,根据方程式2CaO2
,根据方程式2CaO2![]() 2CaO+O2↑可知过氧化钙的物质的量是
2CaO+O2↑可知过氧化钙的物质的量是![]() ,质量是
,质量是![]() ,所以产品中CaO2的质量分数为
,所以产品中CaO2的质量分数为![]() 。
。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案