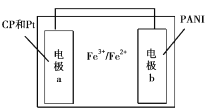
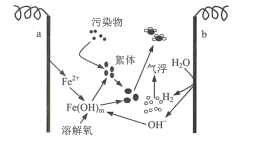
题目内容
【题目】碳、氮、氧、氟、硫是中学常见的非金属元素,铁离子可与由这几种元素组成的SCN-、CN-、F-等形成很多配合物。
(1)基态Fe原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
(2)已知(CN)2是直线形分子,并有对称性,则(CN)2中π键和σ键的个数比为__;在配合物[Fe(SCN)]2+中,提供空轨道接受孤对电子的微粒是__。
(3)配合物K4[Fe(CN)6]中不存在的作用力是__(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
(4)写出一种与SCN-互为等电子体的分子__(用化学式表示),该分子的空间构型为__。
(5)已知乙烯酮(CH2=C=O)是一种重要的有机中间体,可由CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子的杂化轨道类型是__。1mol(C2H5O)3P=O分子中含有的σ键的物质的量为__。
【答案】N 16 4:3 Fe3+ C CS2 直线形 sp2杂化和sp1杂化 25mol
【解析】
(1)Fe原子核外电子数为26,基态原子核外电子排布为1s22s22p63s23p63d64s2,据此分析解答;
(2)(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N,据此分析解答;
(3)钾离子和六氰合亚铁离子之间是离子键,六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N极性共价键,据此分析解答;
(4)原子总数、价电子总数相同的微粒互为等电子体,根据价层电子对互斥理论判断分子空间构型;
(5)乙烯酮分子中碳原子均没有孤对电子,CH2中C原子形成3个σ键,而C=O中碳原子形成2个σ键,杂化轨道数目分别为3、2;根据(C2H5O)3P=O分子的结构分析解答。
(1)Fe原子核外电子数为26,基态原子核外电子排布为1s22s22p63s23p63d64s2,电子占据的最高能层符号为N,该能层具有的原子轨道数为1+3+5+7=16,故答案为:N;16;
(2)(CN)2是直线型分子,并有对称性,则结构式为N≡C-C≡N,(CN)2中π键和σ键的个数比为4∶3;在配合物离子[Fe(SCN)]2+中,中心离子是Fe3+,提供提供空轨道接受孤对电子,故答案为:4:3;Fe3+;
(3)K+和[Fe(CN)6]4-离子之间是离子键,六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,不存在非极性共价键,故答案为:C;
(4)原子总数、价电子总数相同的微粒互为等电子体,与SCN-互为等电子体的分子为CS2或CO2,其中心原子的价电子对数为2+![]() =2,无孤对电子,所以分子空间构型为直线型,故答案为:CS2或CO2;直线形;
=2,无孤对电子,所以分子空间构型为直线型,故答案为:CS2或CO2;直线形;
(5)乙烯酮分子中碳原子均没有孤对电子,CH2中C原子形成3个σ键,而C=O中碳原子形成2个σ键,杂化轨道数目分别为3、2,所以碳原子的杂化轨道类型有sp2和sp,(C2H5O)3P=O分子含有15个C-H键,3个C-C键,3个C-O键3个P-O键和1个P=O键,共25个σ键,则1mol(C2H5O)3P=O分子中含有的σ键为25mol,故答案为:sp2和sp;25mol。

【题目】有机物A为天然蛋白质水解产物,含有C、H、N、O四种元素。某研究小组为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)将A加热使其气化,测其密度约为相同条件下空气密度的4.6倍。 | A的相对分子质量为_____ |
(2)将26.6gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰、灼热的铜网(假设每次气体被完全吸收),前两者分别增重12.6g和35.2g,通过铜网后收集到的气体为2.24L(标准状况下)。 | A的分子式为_______ |
(3)另取13.3gA,与足量的NaHCO3粉末完全反应,生成气体4.48L(标准状况下)。 | A中含有的官能团名称为____ |
(4)A的核磁共振氢谱显示五组峰且峰面积比为1:1:1:2:2。 | A的结构简式为_______ |
(5)两分子A反应生成一种六元环状化合物的化学方程式为_________ | |
【题目】现有前四周期的5种元素的部分信息如下表所示:
元素代号 | 元素部分信息 |
X | X的阴离子核外电子云均呈球形 |
Y | 原子的最高能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大 |
Z | 基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和 |
R | 元素原子的最外层电子排布式为nsn-1npn-1 |
T | 一种核素的质量数为65,中子数为36 |
根据上述元素信息,回答下列问题。
(1)基态T2+的电子排布式为__。
(2)Y、Z、R的电负性由大到小的顺序为__(用元素符号表示)。
(3)YX4+的空间构型为__,离子中![]() 原子的杂化轨道类型为___,YX4+的电子式为__。
原子的杂化轨道类型为___,YX4+的电子式为__。
(4)YX3的一种等电子体分子是__,YX3的键角大于X2Z的键角的主要原因是__。