题目内容
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
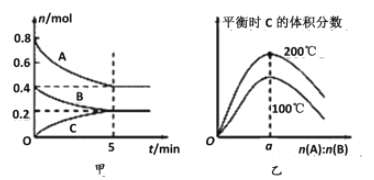
A. 200℃时,反应从开始到平衡的平均速率v(A)=v(B)
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
【答案】B
【解析】
A项,由图甲,200℃时,反应从开始到平衡的平均速率v(A)=(0.8-0.4)÷2L÷5min=0.04molL-1min-1,v(B)=(0.4-0.2)mol÷2L÷5min=0.02molL-1min-1,所以v(A)≠v(B),故A错误;B项,由图甲数据可知反应的A、B与生成的C的物质的量之比为=(0.8-0.4):(0.4-0.2):0.2=2:1:1,所以该反应的化学方程式为2A+B![]() C,A、B、C的平衡浓度分别为:c(A)=(0.8-0.4)÷2L=0.2molL-1,c(B)=(0.4-0.2)÷2L=0.1molL-1,c(C)=0.2÷2L=0.1molL-1,K=
C,A、B、C的平衡浓度分别为:c(A)=(0.8-0.4)÷2L=0.2molL-1,c(B)=(0.4-0.2)÷2L=0.1molL-1,c(C)=0.2÷2L=0.1molL-1,K=![]() =
=![]() =25,故B正确;C项,当外界条件由200℃降温到100℃,化学平衡常数发生变化,原平衡一定被破坏,正逆反应速率均减小,故C错误;D项,前面已推出该反应的方程式为2A+B
=25,故B正确;C项,当外界条件由200℃降温到100℃,化学平衡常数发生变化,原平衡一定被破坏,正逆反应速率均减小,故C错误;D项,前面已推出该反应的方程式为2A+B![]() C,只有当两种反应物按照化学方程式的计量数之比加入时生成物C达到平衡时含量才会最高,故a=2,由图乙可知:升高温度,平衡时C的体积分数增大。说明升高温度化学平衡向正反应方向移动,所以正反应为吸热反应,△H>0,故D错误。
C,只有当两种反应物按照化学方程式的计量数之比加入时生成物C达到平衡时含量才会最高,故a=2,由图乙可知:升高温度,平衡时C的体积分数增大。说明升高温度化学平衡向正反应方向移动,所以正反应为吸热反应,△H>0,故D错误。