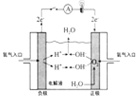
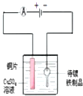
题目内容
20.生活中处处有化学,下列表述不正确的是( )| A. | 玻璃、陶瓷、水泥、光导纤维的化学组成都是硅酸盐 | |
| B. | 污水处理中的化学方法有混凝法、中和法、沉淀法、氧化还原法等 | |
| C. | 对不可回收垃圾常用的处理方法有卫生填埋、堆肥和焚烧 | |
| D. | 固体煤经处理变为气体燃料后,可以减少SO2和烟尘的污染,且燃烧效率高 |
分析 A.二氧化硅属于氧化物;
B.现代废水处理方法主要分为物理处理法、化学处理法和生物处理法三类,
化学处理法有:中和法、化学混凝法、氧化还原法等;
物理处理法有:通常采用沉淀、过滤、离心分离、气浮、蒸发结晶、反渗透等方法;
生物处理法又分为需氧处理和厌氧处理两种方法;
C.对环境不产生污染的垃圾可卫生掩埋、堆肥;
D.煤经处理变为气体燃料后,燃烧更加充分,能量利用率更高,可以减少有害和烟尘的排放.
解答 解:A.光导纤维的化学组成二氧化硅属于氧化物,不属于硅酸盐,故A错误;
B.混凝法、中和法、加入化学试剂的沉淀法、氧化还原法等都属于化学处理污水的方法,故B正确;
C.对环境不产生污染的垃圾可卫生掩埋、堆肥,有些垃圾可焚烧,但产生污染性气体的垃圾不能焚烧,故C正确;
D.煤经处理变为气体燃料后,燃烧更加充分,提高了燃烧效率,能量利用率更高,可以减少有害和烟尘的排放,有利于“节能减排”,故D正确;
故选:A.
点评 本题考查了能源的利用与环境保护、玻璃的成分等生产生活中常见问题,熟悉相关知识是解题关键,题目难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
5.下面说法中正确的是( )
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
12.硫代硫酸钠是一种常见的化工原料,将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:2NaS+Na2CO3+4SO2═3Na2S2O3+CO2
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是赶走水中的溶解氧(或空气).
(2)用该方法获得的Na2S2O3.5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究.
【提出假设】
该晶体中含有的杂质可能是:Na2CO3、Na2SO3、S、Na2S等中的一种或几种,若晶体中混有Na2SO3,则生成Na2SO3的化学方程式为SO2+Na2CO3═Na2SO3+CO2
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?不合理 (填“合理”、“不合理”)并说明理由:Na2S2O3与稀H2SO4反应生成的SO2和硫化钠与硫酸反应的H2S发生反应生成硫单质,可能无H2S逸出
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选).
限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3)已知:2Na2S2O3+I2═2NaI+Na2S4O6..为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol•L-1的碘水进行多次取样滴定,测得Na2S2O3•5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水.
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是赶走水中的溶解氧(或空气).
(2)用该方法获得的Na2S2O3.5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究.
【提出假设】
该晶体中含有的杂质可能是:Na2CO3、Na2SO3、S、Na2S等中的一种或几种,若晶体中混有Na2SO3,则生成Na2SO3的化学方程式为SO2+Na2CO3═Na2SO3+CO2
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?不合理 (填“合理”、“不合理”)并说明理由:Na2S2O3与稀H2SO4反应生成的SO2和硫化钠与硫酸反应的H2S发生反应生成硫单质,可能无H2S逸出
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选).
限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
9.下列有关说法正确的是( )
| A. | 已知:HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,则氢气的燃烧热为△H=-285.8kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4kJ/mol |
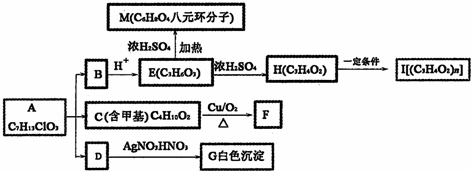
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;②E→M:2HOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$
+2H2O;②E→M:2HOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$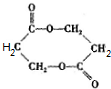 +2H2O;
+2H2O;