��Ŀ����
����Ŀ������ʥ·��˹��ѧ�������͵��Ҵ�ȼ�ϵ�أ������ӣ�H+���ܼ�����200�����ҹ��磮����ܷ�ӦΪ��C2H5OH+3O2��2CO2+3H2O����ͼ�Ǹõ�ص�ʾ��ͼ������˵����ȷ���ǣ� �� 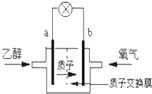
A.a��Ϊ��ص�����
B.��ع���ʱ������a���ص��߾������ٵ�b��
C.��������ĵ缫��ӦΪ��4H++O2+4e���T2H2O
D.��ع���ʱ��1mol�Ҵ�������ʱ����6mol����ת��
���𰸡�C
���������⣺A��ԭ��ع���ʱ���������������ƶ�����aΪ��������A����
B����ع���ʱ�����������������·�������ڸõ������b������a������B����
C�����������õ����ӱ���ԭ���缫��ӦʽΪ4H++O2+4e��=2H2O����C��ȷ��
D���Ҵ���CԪ�صĻ��ϼ�Ϊ��2�ۣ������������ߵ�+4�ۣ����ع���ʱ��1mol�Ҵ�������ʱ����12mol����ת�ƣ���D����
��ѡC��
�����ӵ��ƶ������֪aΪ������a�������Ҵ�ʧ���ӷ���������Ӧ���Ҵ�����������CO2��H+ �� �缫��ӦʽΪC2H5OH+3H2O��12e���T2CO2+12H+ �� bΪ������������ԭ��Ӧ���缫����ʽΪ4H++O2+4e���T2H2O���Դ˽����⣮

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�����Ŀ������β�����������������ԭ��֮һ��
��1������β���к���CO��NO2���ж������������װβ������װ�ÿ�ʹ�ж��������Ӧת��Ϊ�����壮 д���÷�Ӧ���Ȼ�ѧ����ʽ ��
N2��g��+2O2��g���T2NO2��g����H=+68.0kJmol��1��
2C��s��+O2��g���T2CO��g����H=��221.0kJmol��1��
C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��2������β���к���CO��H2O��g����һ�������¿��Է�����Ӧ
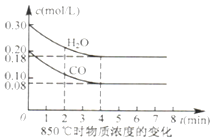
CO��g��+H2O��g��CO2��g��+H2��g����H��0.850�������Ϊ10L��Ӧ����ͨ��һ������CO��H2O��g������������ӦCO��H2O��g����Ũ�ȱ仯��ͼ��ʾ��0��4min��ƽ����Ӧ����v��H2O��=��ʱK= ��
��ʼ���ʵ��� | �� | �� | �� |
n��H2O��/mol | 0.10 | 0.20 | 0.20 |
n��CO��/mol | 0.10 | 0.10 | 0.20 |
850���ڼס��ҡ�������1L�ĺ����ܱ������У���ʼʱ���ձ�����Ͷ�ϣ��ﵽƽ��״̬��ƽ��ʱ��������CO��ת������ �� �Ƚ�����������CO��ת���ʼ��ң�����ڡ������������ڡ�����
����Ŀ������β�����������������ԭ��֮һ��
��1������β���к���CO��NO2���ж������������װβ������װ�ÿ�ʹ�ж��������Ӧת��Ϊ�����壮 д���÷�Ӧ���Ȼ�ѧ����ʽ ��
N2��g��+2O2��g���T2NO2��g����H=+68.0kJmol��1��
2C��s��+O2��g���T2CO��g����H=��221.0kJmol��1��
C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��2������β���к���CO��H2O��g����һ�������¿��Է�����Ӧ
CO��g��+H2O��g��CO2��g��+H2��g����H��0.850�������Ϊ10L��Ӧ����ͨ��һ������CO��H2O��g������������ӦCO��H2O��g����Ũ�ȱ仯��ͼ��ʾ��0��4min��ƽ����Ӧ����v��H2O��=��ʱK= ��
��ʼ���ʵ��� | �� | �� | �� |
n��H2O��/mol | 0.10 | 0.20 | 0.20 |
n��CO��/mol | 0.10 | 0.10 | 0.20 |
850���ڼס��ҡ�������1L�ĺ����ܱ������У���ʼʱ���ձ�����Ͷ�ϣ��ﵽƽ��״̬��ƽ��ʱ��������CO��ת������ �� �Ƚ�����������CO��ת���ʼ��ң�����ڡ������������ڡ�����