��Ŀ����
��12�֣���һ�ݻ�Ϊ2 L���ܱ������У�����0.2 mol��N2��0.6 mol��H2����һ�������·�����Ӧ��N2(g)��3H2(g) 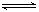 2NH3(g)����H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g)����H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺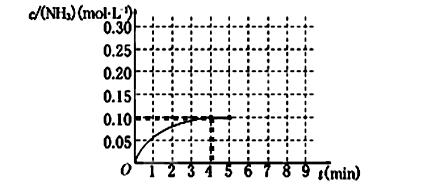
��1��������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��������ƽ����Ӧ����v(H2)Ϊ______________��
��2���÷�Ӧ�ﵽƽ��ʱN2��ת����_________________��
��3����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ____________��(�����)
a��0.20 mol��L��1 b��0.12 mol��L��1 c��0.10 mol��L��1 d��0.08 mol��L��1
��4����д���÷�Ӧ��ƽ�ⳣ������ʽ_________�����÷�Ӧ��298K��398Kʱ�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2����K1 K2�����������="��" �� ������ ����
��5���ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ��(��ʱNH3��Ũ��ԼΪ0.25 mol��L��1)��������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߡ�
��1��0.0375 mol��L��1��min��1
��2��50%
��3��a��c
��4��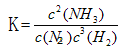 >
>
��5��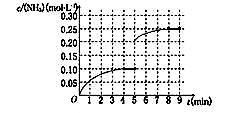
���������������1������v��H2��= 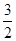 c��NH3�����м��㣬v��H2��=
c��NH3�����м��㣬v��H2��= 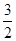 c��NH3��=
c��NH3��=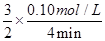 =0.0375 mol��L��1��min��1
=0.0375 mol��L��1��min��1
��2�����ݰ�����Ũ��������ɰ��������ʵ���Ϊ0.2mol����Ӧ�ĵ���Ϊ0.1mol��ת����Ϊ50%��
��3���÷�ӦΪ���淴Ӧ����Ӧ�ﲻ������ȫת������NH3�����ʵ���Ũ�Ȳ�����Ϊ0.2mol/L���¶ȸı�ƽ��һ�������ƶ�����NH3�����ʵ���Ũ�Ȳ�����Ϊ0.1mol/L���ʴ�Ϊ��a��c��
��4��ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮����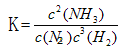 ����Ϊ�÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ�KֵԽС��K1>K2��
����Ϊ�÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ�KֵԽС��K1>K2��
��5����5����ĩ�������������Сһ�������Ũ��Ϊԭ����һ����ѹǿ����ƽ�����������ƶ���������Ũ��������8minʱ�ﵽƽ�⣬Ũ��ԼΪ0.25mol/L����ͼ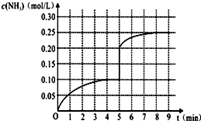
���㣺��ѧƽ�ⳣ���ĺ��壻��Ӧ���ʵĶ�����ʾ��������ѧƽ���Ӱ�����أ���ѧƽ��״̬���жϡ�
���������⿼�黯ѧƽ���ƶ����⣬�漰ƽ�ⳣ������Ӧ���ʡ�ƽ���־�Լ�ƽ��ͼ������⣬��Ŀ�Ѷ��еȣ�ע�ⷽ��������Ļ��ۡ�

 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д� �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�(16��)���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã��ϳɰ���ҵ�ڹ�������������Ҫ���塣�����ǹ��ںϳɰ����й����⣬��ش�
��1������һ�ݻ�Ϊ2 L���ܱ������м���0.2 mol��N2��0.6 mol��H2��һ�������·�����Ӧ: N2(g) +3H2(g) 2NH3(g) ��H<0������5����ʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol����ǰ5���ӵ�ƽ����Ӧ����v(N2)= ��ƽ��ʱH2��ת����Ϊ ��?
2NH3(g) ��H<0������5����ʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol����ǰ5���ӵ�ƽ����Ӧ����v(N2)= ��ƽ��ʱH2��ת����Ϊ ��?
��2��ƽ�����Ҫ���H2��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��?
A.���˴��� B.�����������?C.���ͷ�Ӧ��ϵ���¶� D.����һ����N2?
��3������0.5 L���ܱ������У�һ�����ĵ����������������·�Ӧ��?
N2(g)+3H2(g) 2NH3(g) ��H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��?
2NH3(g) ��H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��?
| T/�� | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
������������⣺?
���ԱȽ�K1��K2�Ĵ�С��K1 K2���<����>����������?
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������� ���������ĸ��
A.������N2��H2��NH3�����ʵ���Ũ��֮��Ϊ1:3:2? B.v(H2)����3v(H2)��?
C.������ѹǿ���ֲ���?D.���������ܶȱ��ֲ���?
��400��ʱ����Ӧ2NH3(g)
 N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ��Ϊ �������NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����÷�Ӧ��v(N2)�� v(N2)�����<����>����������?
N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ��Ϊ �������NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����÷�Ӧ��v(N2)�� v(N2)�����<����>����������?��4�����ݻ�ѧ��Ӧ���ʺͻ�ѧƽ�����ۣ���ϵ�ϳɰ�������ʵ�ʣ�����Ϊ����˵������ȷ���� ��
A.��ѧ��Ӧ�������ۿ�ָ��������һ��ʱ���ڿ����Ʒ?
B.��������ԭ����ָ������ʹ������ԭ�϶����Ʒ?
C.������ʹ������߲�Ʒ���ʵ���Ч����?
D.��ȷ���û�ѧ��Ӧ���ʺͻ�ѧ��Ӧ�����۶�����������������ۺϾ���Ч��

 3C(g)���ﵽƽ�������1.5 mol C����ʱ��ƽ��������C���������Ϊ�أ������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ1.2 mol��
3C(g)���ﵽƽ�������1.5 mol C����ʱ��ƽ��������C���������Ϊ�أ������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ1.2 mol�� 2NH3(g)����H��0
2NH3(g)����H��0
 2NH3(g) ��H��0,��Ӧ��NH3�����ʵ���Ũ�ȵı仯���������ͼ��
2NH3(g) ��H��0,��Ӧ��NH3�����ʵ���Ũ�ȵı仯���������ͼ��