��Ŀ����
��20�֣���֪��
��1��2C��ʯīs����O2 (g) =" 2" CO(g) ��H=��222KJ/mol
(g) =" 2" CO(g) ��H=��222KJ/mol
��2��2 H2(g����O2(g)="2" H2O(g) ��H=��484KJ��mol
��3��C��ʯīs����O2��g��=CO2��g�� ��H=��393.5KJ/mo l
l
��4��H2O(g��=H2O��L) ��H=��44KJ/mol
��5��C�����ʯs����O2(g)=CO2(g) ��H=��395.4KJ/mol
�ش��������⣺
��1��C��ʯī����ȼ����Ϊ ��
��2��д����ʾH2��ȼ���ȵ��Ȼ�ѧ����ʽ��  ��
��
��3��д��ʯīת��Ϊ���ʯ���Ȼ�ѧ����ʽ���ɲ�ע�������� ����Ը��ȶ��������� ��
��4����ҵ����H2��һ����Ҫ��Ӧ�ǣ�CO(g)+H2O(g)?CO2 (g)+H2(g)
�ٸ÷�Ӧ�ġ�H= ��
��Ϊ�����CO��ת���ʣ����д�ʩ�ɲ��õ��� ��
| A�������¶� | B������ѹǿ |
| C��ѡ����ʵĴ��� | D������H2O(g)��Ũ�� |
��800��ʱ���÷�Ӧ��ƽ�ⳣ��K=1����850��ʱK 1���������������
��800��ʱ������ʼŨ�ȣ�C(CO)="1" mol/L�� C(H2O)=4mol/L�����ƽ��ʱ��C(H2��= ��CO��ת����Ϊ ��
��20�֣�
��1��393.5KJ/mol
��2��H2(g)+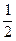 O2(g)=H2O(L) ��H=��286KJ/mol
O2(g)=H2O(L) ��H=��286KJ/mol
��3��C��ʯīs��=C�����ʯs�� ��H="+1.9KJ/mol " ʯī
��4���٣�40.5KJ/mol ��D ��K=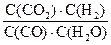 ��<1 ��0.8mol/L, 80%
��<1 ��0.8mol/L, 80%
����

 ����ѧ����ϵ�д�
����ѧ����ϵ�д���101kPa�£�2C��ʯī��s��+O2��g��=2CO��g����H=-221kJ?mol-1
��C��ʯī��s��=C�����ʯ��s����H=-1.91kJ?mol-1
����ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ?mol-1�������й�˵����ȷ���ǣ�������
| A�����ʯ��ʯī�ȶ� | B��ʯī����ֵ��9.2kJ?g-1�� | C������ǿ����ǿ�Ӧ����1molH2Oʱ�ų���������Ϊ57.3kJ | D��1mol������1mol����������ϡ��Һ����ȫ��Ӧʱ���ų�����������57.3kJ |