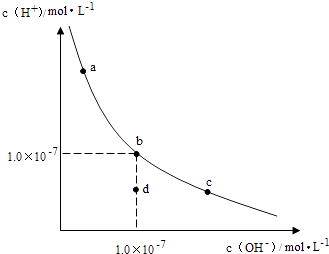
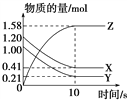
题目内容
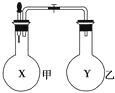
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。 
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,可向污水中加入适量的。 a.Na2SO4 b.H2SO4 c.NaOH d.CH3COOH e.NaCl
(2)除污过程中污水池中阳离子将移向极(填:“正”或“负”或“阴”或“阳”)。
(3)电解池阳极发生了两个电极反应,电极反应式是 Ⅰ. Fe-2e-=Fe2+ Ⅱ.。
(4)以上电解过程是以上图右侧的燃料电池为电源,该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。 ①负极的电极反应是;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的电子式为。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
【答案】
(1)ae
(2)阴
(3)4OH-- 4 e-= 2H2O+O2↑
(4)O2+2CO2+4e-=2CO32- ;
(5)11.2
【解析】(1)为了增强溶液的导电性,且要保持污水的pH在5.0~6.0之间,因此加入的使导电能力增强的电解质必须是可溶于水的、显中性的盐,所以答案选ae。(2)电解池中阳离子得到电子,向阴极移动。(3)电解池中阳极失去电子,则另一个电极反应式应该是溶液中的OH-放电,即4OH-- 4 e-= 2H2O+O2↑。(4)①料电池中,正极反应一定是氧气得到的电子的过程,该电池的电解质是熔融碳酸盐,所以电极反应为O2+2CO2+4e-=2CO32-。②电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳。CO2是含有共价键的共价化合物,电子式是 ![]() 。(5)阴极的电极反应为2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol。根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O可知,当转移4mol电子时,消耗CH4的物质的量是0.5mol,则在标准状况下的体积V=nVm=0.5mol×22.4L/mol=11.2L。
。(5)阴极的电极反应为2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol。根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O可知,当转移4mol电子时,消耗CH4的物质的量是0.5mol,则在标准状况下的体积V=nVm=0.5mol×22.4L/mol=11.2L。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体;继续滴加至液溴滴完;装置d的作用是________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________________________________________ 。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中可行的是________(填字母)。
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL