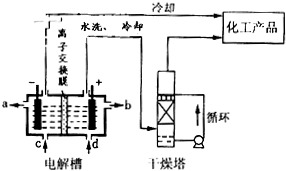
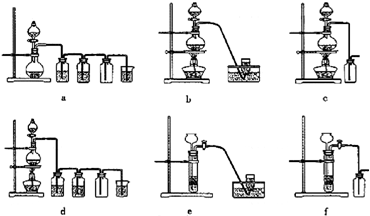
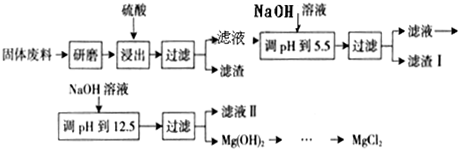
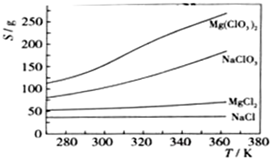
题目内容
I.相同质量的钠、镁、铝分别与足量的盐酸反应,放出的气体物质的量之比为 .II.请写出以下物质溶于水的电离方程式:
H2SO4
NaOH
并据此回答:
0.5molH2SO4的质量是 ,电离产生的H+为 个,能和 g NaOH完全反应,该硫酸所含氢元素的质量与 molH3PO4或 HCl中所含氢元素的质量相同.
【答案】分析:Ⅰ.根据n=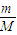 计算各金属的物质的量,根据反应的关系式计算;
计算各金属的物质的量,根据反应的关系式计算;
Ⅱ.H2SO4和NaOH为强电解质,完全电离,根据n=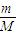 =
=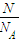 结合分子组成计算各物理量.
结合分子组成计算各物理量.
解答:解:Ⅰ.设金属的质量都为mg,则n(Na)=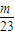 mol,n(Mg)=
mol,n(Mg)=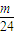 mol,n(Al)=
mol,n(Al)=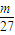 mol,
mol,
又:Na~ H2,Mg~H2,Al~
H2,Mg~H2,Al~ H2,
H2,
放出的气体物质的量之比为 ×
× mol:
mol: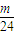 mol:
mol: ×
×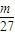 mol=36:69:92,
mol=36:69:92,
故答案为:36:69:92;
Ⅱ.H2SO4和NaOH为强电解质,完全电离,
则有:H2SO4═2H++SO42-;NaOH═Na++OH-;
m(H2SO4)=0.5mol×98g/mol=49g,
n(H+)=2n(H2SO4)=2×0.5mol=1mol,
N(H+)=n?NA=1mol×6.02×1023/mol=6.02×1023,
根据H++OH-=H2O,
则n(NaOH)=n(H+)=1mol,
m(NaOH)=1mol×40g/mol=40g,
n(H3PO4)= n(H+)=
n(H+)= ×1mol=
×1mol= mol,
mol,
n(HCl)=n(H+)=1mol,
m(HCl)=1mol×36.5g/mol=36.5g,
故答案为:H2SO4═2H++SO42-;NaOH═Na++OH-;49g;6.02×1023;40; ;36.5g.
;36.5g.
点评:本题考查物质的量的相关计算,题目难度不大,注意有关计算公式的运用.
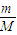 计算各金属的物质的量,根据反应的关系式计算;
计算各金属的物质的量,根据反应的关系式计算;Ⅱ.H2SO4和NaOH为强电解质,完全电离,根据n=
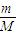 =
=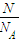 结合分子组成计算各物理量.
结合分子组成计算各物理量.解答:解:Ⅰ.设金属的质量都为mg,则n(Na)=
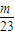 mol,n(Mg)=
mol,n(Mg)=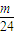 mol,n(Al)=
mol,n(Al)=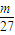 mol,
mol,又:Na~
 H2,Mg~H2,Al~
H2,Mg~H2,Al~ H2,
H2,放出的气体物质的量之比为
 ×
× mol:
mol: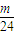 mol:
mol: ×
×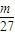 mol=36:69:92,
mol=36:69:92,故答案为:36:69:92;
Ⅱ.H2SO4和NaOH为强电解质,完全电离,
则有:H2SO4═2H++SO42-;NaOH═Na++OH-;
m(H2SO4)=0.5mol×98g/mol=49g,
n(H+)=2n(H2SO4)=2×0.5mol=1mol,
N(H+)=n?NA=1mol×6.02×1023/mol=6.02×1023,
根据H++OH-=H2O,
则n(NaOH)=n(H+)=1mol,
m(NaOH)=1mol×40g/mol=40g,
n(H3PO4)=
 n(H+)=
n(H+)= ×1mol=
×1mol= mol,
mol,n(HCl)=n(H+)=1mol,
m(HCl)=1mol×36.5g/mol=36.5g,
故答案为:H2SO4═2H++SO42-;NaOH═Na++OH-;49g;6.02×1023;40;
 ;36.5g.
;36.5g.点评:本题考查物质的量的相关计算,题目难度不大,注意有关计算公式的运用.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目