题目内容
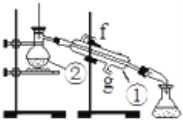
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。如图1装置是用燃烧法确定有机物分子式常用的装置。
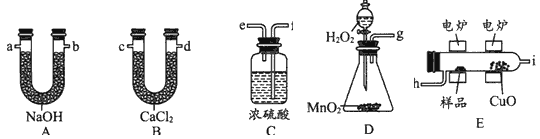
(1)D装置中MnO2的作用是_________________。
(2)燃烧管中CuO的作用是_____________________。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为__________________。
(4)用质谱仪测定其相对分子质量,得如图2所示的质谱图,则该有机物的相对分子质量为___。
(5)该物质的核磁共振氢谱如图二所示,则其结构简式为_____________。
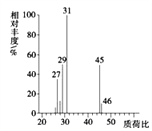
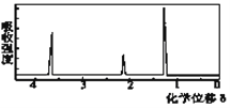
图2 图3
【答案】 作催化剂、加快O2的速率 使有机物更充分氧化为CO2、H2O C2H6O 46 CH3CH2OH
【解析】D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则
(1)MnO2为双氧水分解制备氧气的催化剂,可加快反应速率;(2)一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知,CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;(3)A管质量增加1.76g说明生成了1.76g二氧化碳,可得碳元素的质量:1.76g×12/44×100%=0.48g,B管质量增加1.08g说明生成了1.08g水,可得氢元素的质量:1.08g×2/18×100%=0.12g,从而可推出含氧元素的质量为:0.92g-0.48g-0.12g=0.32g,设实验式为CxHyOz,则x:y:z=0.48/12:0.12/1:0.32/16=2:6:1,则其实验式为:C2H6O;(4)质谱图可知有机物的相对分子质量为46;(5)有机物的实验式为:C2H6O,设分子式为(C2H6O)n,相对分子质量为46n,而有机物的相对分子质量为46,则n=1,所以分子式为C2H6O;(6)核磁共振氢谱中给出3种峰,说明该分子中有3种H原子,所以其结构简式为:CH3CH2OH。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100ml0.10molL1NaOH标准溶液,计算需称量_____g氢氧化钠固体。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加23滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是____________________________________________.
②根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:___________
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C. 锥形瓶水洗后未干燥
D. 称量NaOH固体中混有Na2CO3固体
E. 配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F. 碱式滴定管尖嘴部分有气泡,滴定后消失。
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |