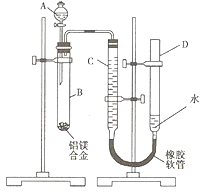
题目内容
经精选后的铝土矿A(主要成份为Al2O3,含有一定量的Fe2O3、SiO2杂质),可用A来制备电解铝原料——氧化铝,某课外小组同学模拟该过程,设计了如下方案:
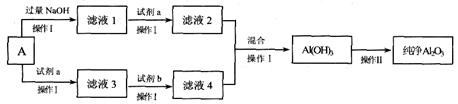
请回答:
(1)A中Al2O3与过量氢氧化钠溶液反应的化学方程式是________________
(2)操作I的名称是________________。
(3)下列说法中正确的是________(填选项)。
a 操作Ⅱ是灼烧 b. 滤液3所含阳离子是Fe3+、Al3+
c. 试剂b可用氢氧化钠 d. 为保证转化完全,所加试剂a和试剂b均应过量
(4)写出滤液2、4混合后生成Al(OH)3的离子方程式是______________________ __

请回答:
(1)A中Al2O3与过量氢氧化钠溶液反应的化学方程式是________________
(2)操作I的名称是________________。
(3)下列说法中正确的是________(填选项)。
a 操作Ⅱ是灼烧 b. 滤液3所含阳离子是Fe3+、Al3+
c. 试剂b可用氢氧化钠 d. 为保证转化完全,所加试剂a和试剂b均应过量
(4)写出滤液2、4混合后生成Al(OH)3的离子方程式是______________________ __
(7分)(1)Al2O3+2NaOH=2NaAlO2+H2O(2分)(2)过滤(1分)
(3)acd(2分) (4)3AlO2-+Al3++6H2O=4 Al(OH)3↓ (2分)
(3)acd(2分) (4)3AlO2-+Al3++6H2O=4 Al(OH)3↓ (2分)
试题分析:(1)氧化铝是两性氧化物,所以Al2O3与过量氢氧化钠溶液反应的化学方程式是Al2O3+2NaOH=2NaAlO2+H2O。
(2)由于氧化铁和氢氧化钠溶液不反应,所以所以从溶液中分离固体的实验操作名称是过滤。
(3)氢氧化铝灼烧即生成氧化铝,a正确;由于二氧化硅不能和盐酸反应,所以试剂a可以是盐酸,则滤液3中Fe3+、Al3+和氢离子,b不正确。将Fe3+、Al3+分离开的试剂可以是氢氧化钠溶液,c正确;为保证转化完全,所加试剂a和试剂b均应过量,d正确,答案选acd。
(4)滤液2中含有AlO2-,能和Al3+反应生成白色沉淀氢氧化铝,则滤液2、4混合后生成Al(OH)3的离子方程式是3AlO2-+Al3++6H2O=4 Al(OH)3↓。
点评:本题以流程图来呈现实验过程的探究性考题,是高考中的常见题型之一。读懂实验流程图,明确实验步骤和原理,是正确解答此类问题的前提,有利于激发学生的学习兴趣和学习积极性。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
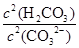 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”)