题目内容
【题目】利用手持技术探究氢氧化铝制备实验电导率(电导率越大表示导电能力越强)的变化,浓度均为0.5 mol·L-1 的氢氧化钠和氨水分别滴定0.01 mol·L-1硫酸铝溶液,电导率变化曲线如图所示,下列说法错误的是
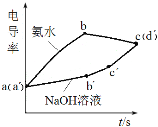
A.a(a)点溶液pH<7
B.bc段电导率下降是因为生成了Al(OH)3沉淀
C.ab段和bc段使用碱的体积比约为3:1
D.b点溶液:c(H+)<2c(SO42-)+c(OH-)
【答案】B
【解析】
A. 硫酸铝溶液水解呈酸性,a(a)点溶液pH<7,故A正确;
B. ab段生成了Al(OH)3沉淀,b点溶质为(NH4)2SO4,一水氨为弱电解质,加氨水后,电导率下降是因为:溶液中离子浓度降低,故B错误;
C. ab段生成Al(OH)3 沉淀,Al3++3OH-=Al(OH)3,bc段Al(OH)3+OH=AlO2-+2H2O,使用碱的体积比约为3:1,故C正确;
D.b点Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4,根据电荷守恒,c(H+)+c(NH4+)=2c(SO42-)+c(OH-),b点溶液:c(H+)<2c(SO42-)+c(OH-),故D正确;
故选B。

【题目】滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
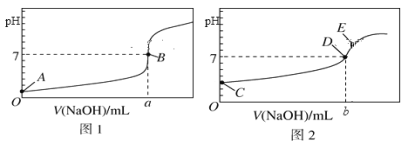
(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________(电离度=![]() ×100%)。
×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差在本实验的滴定过程中,下列操作会使实验结果偏大的是_________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数
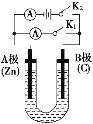
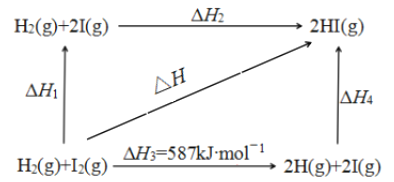
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)C2H4(g)+2H2(g) ΔH>0
化学键 | H—H | C—H | C=C | C—C |
E(kJ/mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=____________ (用含a、b、c、d的代数式表示)。
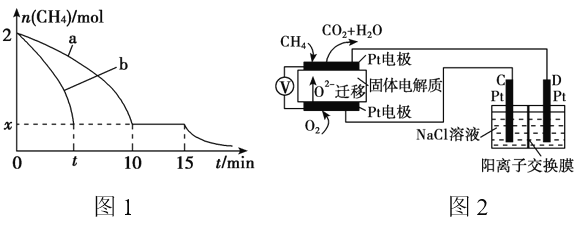
(2)T1温度时,向1 L的恒容反应器中充入2mol CH4 ,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为__________mol/(L·min)。
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填“a”或 “b”)。
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是_____________________________________(任答一条即可)。
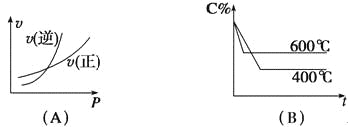
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正____v逆(填“>”“=”或“<”),判断的理由是_________________ 。
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为______ 极(填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=_______ (假设电解前后NaCl溶液的体积均为500mL)。