题目内容
碳酸铵〔(NH4)2CO3·H2O〕是一种白色晶体,在空气中逐渐失氨而成碳酸氢铵,在58 ℃时分解为NH3、CO2和H2O。
现有一包碳酸铵样品,为确定它的成分,进行以下实验:①取样品27.2 g加热,样品全部分解为气体A;②将气体A通过盛有100 mL浓H2SO4的洗气瓶,由洗气瓶导出的气体再通过装有足量Na2O2的干燥管,从干燥管中导出的气体体积为3.36 L(标准状况);③取洗气瓶中的溶液1/10与足量的浓NaOH溶液混合并加热,能生成0.896 L(标准状况)气体。
根据以上实验数据分析、计算、推断:
(1)样品的成分。
(2)样品的含氮量。
现有一包碳酸铵样品,为确定它的成分,进行以下实验:①取样品27.2 g加热,样品全部分解为气体A;②将气体A通过盛有100 mL浓H2SO4的洗气瓶,由洗气瓶导出的气体再通过装有足量Na2O2的干燥管,从干燥管中导出的气体体积为3.36 L(标准状况);③取洗气瓶中的溶液1/10与足量的浓NaOH溶液混合并加热,能生成0.896 L(标准状况)气体。
根据以上实验数据分析、计算、推断:
(1)样品的成分。
(2)样品的含氮量。
(1)样品成分为(NH4)2CO3·H2O和NH4HCO3混合物(5分) (2)20.6%(4分)
(1)由①②可知干燥管中导出的3.36 L 气体为O2,由2Na2O2+2CO2====2Na2CO3+O2知:n(CO2)=2n(O2)= ="0.3" mol;由③知0.896 L气体为NH3,气体A中NH3的物质的量为n(NH3)=
="0.3" mol;由③知0.896 L气体为NH3,气体A中NH3的物质的量为n(NH3)= ="0.4" mol。n(NH3)∶n(CO2)="0.4" mol∶0.3 mol=4∶3,介于2∶1与1∶1之间,所以样品为(NH4)2CO3·H2O与NH4HCO3的混合物。
="0.4" mol。n(NH3)∶n(CO2)="0.4" mol∶0.3 mol=4∶3,介于2∶1与1∶1之间,所以样品为(NH4)2CO3·H2O与NH4HCO3的混合物。
(2)样品中氮元素的质量为0.4 mol×14 g·mol-1="5.6" g,所以w(N)=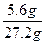 ×100%=20.6%。
×100%=20.6%。
 ="0.3" mol;由③知0.896 L气体为NH3,气体A中NH3的物质的量为n(NH3)=
="0.3" mol;由③知0.896 L气体为NH3,气体A中NH3的物质的量为n(NH3)= ="0.4" mol。n(NH3)∶n(CO2)="0.4" mol∶0.3 mol=4∶3,介于2∶1与1∶1之间,所以样品为(NH4)2CO3·H2O与NH4HCO3的混合物。
="0.4" mol。n(NH3)∶n(CO2)="0.4" mol∶0.3 mol=4∶3,介于2∶1与1∶1之间,所以样品为(NH4)2CO3·H2O与NH4HCO3的混合物。(2)样品中氮元素的质量为0.4 mol×14 g·mol-1="5.6" g,所以w(N)=
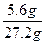 ×100%=20.6%。
×100%=20.6%。
练习册系列答案
相关题目
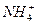 全部转化为NH3,另一份加入c mol BaCl2溶液恰好沉淀完全,则原混合溶液中
全部转化为NH3,另一份加入c mol BaCl2溶液恰好沉淀完全,则原混合溶液中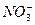 的浓度是( )
的浓度是( )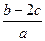 mol·L-1
mol·L-1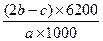 %
%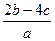 mol·L-1
mol·L-1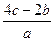 mol·L-1
mol·L-1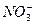 为_______________mol。
为_______________mol。