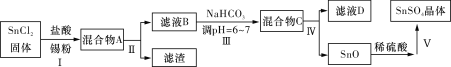
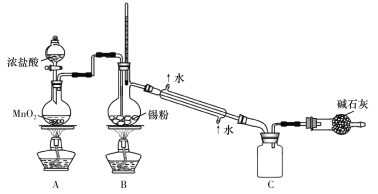
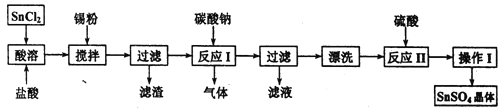
题目内容
【题目】Ⅰ.(1)在一密闭容器中一定量A、B的混合气体发生反应:aA(g)+bB(g) ![]() cC(s)+dD(g),平衡时测得A的浓度为0.60 mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20 mol/L。下列有关判断一定正确的是
cC(s)+dD(g),平衡时测得A的浓度为0.60 mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20 mol/L。下列有关判断一定正确的是
A.平衡向正反应方向移动
B.A的转化率增大
C.D的体积分数增大
D.a+b<c+d
(2)①25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
HSO3-的电离平衡常数表达式K=__________________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为:______________________。
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
Ⅱ.0.98 gCu(OH)2样品受热分解的热重曲线(样品质量随温度变化的曲线)如图所示。
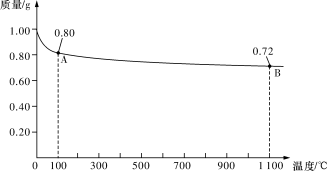
请回答下列问题:
(1)试确定1 100 ℃时所得固体B的化学式(要求写出推理或计算过程)。
(2)固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体反应,得到红色固体单质和气体单质,则该反应的化学方程式为:___________________;若反应中转移0.015 mol电子,则消耗还原剂的物质的量为________________。
(3)取少量固体B于试管中,加入足量的稀硫酸得到蓝色溶液,同时观察到试管中还有红色固体存在,该反应的离子方程式为:________________________。
【答案】
Ⅰ.(1)D
(2)①K=![]()
②H2SO3+HCO3-===CO2↑+H2O+HSO3-
③HSO3-既能水解又能电离,HSO3-的电离常数Ka2=6.3×10-8。HSO3-+H2O![]() H2SO3+OH-,设水解平衡常数为Kh,则Kh=
H2SO3+OH-,设水解平衡常数为Kh,则Kh=![]() =
=![]() =
= ![]() =
= ![]() ≈7.7×10-13<Ka2。由此可知HSO3-电离程度大于水解程度,其溶液显酸性。
≈7.7×10-13<Ka2。由此可知HSO3-电离程度大于水解程度,其溶液显酸性。
Ⅱ:(1)0.98 g Cu(OH)2即0.01 mol,加热至1 100 ℃时失重0.26 g ,则1 mol Cu(OH)2加热至1 100 ℃时失重26 g,加热时失去的重量应为2 mol H原子和1.5 mol O原子,则1 mol Cu(OH)2加热后剩余1 mol Cu和 0.5 mol氧原子,Cu与O原子个数比为2∶1,故剩余固体化学式为Cu2O。
(2)3CuO+2NH33Cu+N2+3H2O 0.005 mol(1分)
(3)Cu2O+2H+===Cu+Cu2++H2O(1分)
【解析】
试题分析:Ⅰ.(1)平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,测得A的浓度降为0.20mol/L,则平衡不移动,则说明降低压强平衡不移动,则A.根据上述分析,平衡不移动,故A错误;降低压强平衡向逆方向移动,说明反应物气体的计量数之和大于生成物气体的计量数,应为x+y>z,故A错误;B.由以上分析可知平衡不移动,A的转化率不变,故B错误;C.平衡不移动,则D的体积分数不变,故C错误;D.平衡不移动,则a+b=d,故推z+b<c+d,故D正确;故选D。
(2)①HSO3-的电离方程式为:HSO3-H++SO32-,平衡常数表达式为K=![]() ,故答案为:
,故答案为:![]() ;
;
②由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;
③HSO3-既能水解又能电离,HSO3-的电离常数Ka2=6.3×10-8,HSO3-+H2O![]() H2SO3+OH-,设水解平衡常数为Kh,则Kh=
H2SO3+OH-,设水解平衡常数为Kh,则Kh=![]() =
=![]() ≈7.7×10-13<Ka2,由此可知HSO3-电离程度大于水解程度,其溶液呈酸性,答:NaHSO3溶液显酸性;
≈7.7×10-13<Ka2,由此可知HSO3-电离程度大于水解程度,其溶液呈酸性,答:NaHSO3溶液显酸性;
Ⅱ:(1)由图可知0.98gCu(OH)2即0.01mol,加热至1100°C时失重0.26g,则1mol Cu(OH)2加热至1100°C时失重26g,加热时失去的重量应为2molH原子和1.5molO原子,则1molCu(OH)2加热后剩余1molCu和 0.5mol氧原子,Cu与O原子个数比为2:1,故剩余固体化学式为Cu2O,答:1100℃时所得固体B的化学式Cu2O;
(2)固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体是氨气,得到红色固体单质是铜和气体单质是氮气,所以反应的化学方程式为:3CuO+2NH3![]() 3Cu+N2+3H2O;每转移6mol的电子消耗还原剂为2mol,反应中转移0.015mol电子,则消耗还原剂的物质的量为
3Cu+N2+3H2O;每转移6mol的电子消耗还原剂为2mol,反应中转移0.015mol电子,则消耗还原剂的物质的量为![]() ×0.015=0.005mol,故答案为:3CuO+2NH3
×0.015=0.005mol,故答案为:3CuO+2NH3![]() 3Cu+N2+3H2O; 0.005mol;
3Cu+N2+3H2O; 0.005mol;
(3)取少量固体氧化亚铜于试管中,加入足量的稀硫酸得到蓝色溶液含铜离子,同时观察到试管中还有红色固体存在是单质铜,是酸性条件下+1价铜发生自身的氧化还原反应,离子方程式为Cu2O+2H+═Cu+Cu2++H2O,故答案为:Cu2O+2H+═Cu+Cu2++H2O。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】下述实验能达到预期目的的是( )
编号 | 实验内容 | 实验目的 |
A | 将Na2CO3和NaHCO3 的固体混合物加热灼烧 | 除去NaHCO3中的Na2CO3 |
B | 常温时将CO通过装有SiO2 的硬质玻璃管 | 制取粗硅 |
C | 向新制得的K2S溶液中滴加新制的氯水 | 比较氯与硫的得电子能力 |
D | 分别向2支盛有冷水的试管中加入相同大小的镁条和铝条。 | 比较镁铝的金属性强弱 |