题目内容
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:

⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
⑵如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。

⑶在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式_______ ______________
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
⑷无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

装置B中盛放饱和NaCl溶液,该装置的主要作用是 ; F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
⑸将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。

⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
⑵如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。

⑶在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式_______ ______________
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
⑷无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

装置B中盛放饱和NaCl溶液,该装置的主要作用是 ; F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
⑸将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(1) 2 Al(OH)3+Mg (OH)2 MgAl2O4 + 4H2O
MgAl2O4 + 4H2O
(2)漏斗下端尖嘴未紧贴烧杯内壁 AgNO3溶液(或硝酸酸化的AgNO3溶液);坩埚
(3)Al(OH)3 Al3++ 3NH3·H2O=Al(OH)3↓+ 3NH4+
(4)除去HCl;吸收水蒸气;碱石灰(或NaOH与CaO混合物)
(5)8.00
 MgAl2O4 + 4H2O
MgAl2O4 + 4H2O (2)漏斗下端尖嘴未紧贴烧杯内壁 AgNO3溶液(或硝酸酸化的AgNO3溶液);坩埚
(3)Al(OH)3 Al3++ 3NH3·H2O=Al(OH)3↓+ 3NH4+
(4)除去HCl;吸收水蒸气;碱石灰(或NaOH与CaO混合物)
(5)8.00
|
 MgAl2O4 + 4H2O。即得到要制备MgAl2O4。⑵在如图所示的过滤操作中的错误是漏斗下端尖嘴未紧贴烧杯内壁。由于沉淀是从金属氯化物中过滤出来的,所以要判断流程中沉淀是否洗净的方法就是用硝酸酸化的AgNO3溶液来检验是否含有Cl-即可。高温焙烧时,要用坩埚来盛放固体物质。⑶Mg2+形成沉淀需要的
MgAl2O4 + 4H2O。即得到要制备MgAl2O4。⑵在如图所示的过滤操作中的错误是漏斗下端尖嘴未紧贴烧杯内壁。由于沉淀是从金属氯化物中过滤出来的,所以要判断流程中沉淀是否洗净的方法就是用硝酸酸化的AgNO3溶液来检验是否含有Cl-即可。高温焙烧时,要用坩埚来盛放固体物质。⑶Mg2+形成沉淀需要的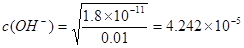 ;而Al3+形成沉淀需要的
;而Al3+形成沉淀需要的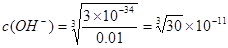 <4.242×10-5。需要的OH-的浓度越小,越容易形成沉淀。因此首先形成的是Al(OH)3沉淀。(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是除去氯气中杂质气体HCl,同时减小氯气的溶解。由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,所以在F中试剂的作用是吸收水蒸气,防止无水AlCl3水解。用干燥管装填碱石灰也可起到F和G的作用。⑸Mg、Cu与硝酸发生反应变为Mg2+、Al3+时失去的电子的物质的量与HNO3得到电子的物质的量相等。而当向反应后的溶液中加入NaOH溶液金属离子恰好完全沉淀时增加的质量就是OH-的质量,其物质的量就等于Mg2+、Al3+时失去的电子的物质的量。根据等量关系可得。n(NO)= 1.792L÷22.4L/mol=0.08mol.所以n(e-)="0.08mol×3=0.24mol." 故形成沉淀的质量为3.92g+0.24mol×17g/mol=8.00g。考点:
<4.242×10-5。需要的OH-的浓度越小,越容易形成沉淀。因此首先形成的是Al(OH)3沉淀。(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是除去氯气中杂质气体HCl,同时减小氯气的溶解。由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,所以在F中试剂的作用是吸收水蒸气,防止无水AlCl3水解。用干燥管装填碱石灰也可起到F和G的作用。⑸Mg、Cu与硝酸发生反应变为Mg2+、Al3+时失去的电子的物质的量与HNO3得到电子的物质的量相等。而当向反应后的溶液中加入NaOH溶液金属离子恰好完全沉淀时增加的质量就是OH-的质量,其物质的量就等于Mg2+、Al3+时失去的电子的物质的量。根据等量关系可得。n(NO)= 1.792L÷22.4L/mol=0.08mol.所以n(e-)="0.08mol×3=0.24mol." 故形成沉淀的质量为3.92g+0.24mol×17g/mol=8.00g。考点:
练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
 6Cu+SO2↑反应中,说法正确的是( )
6Cu+SO2↑反应中,说法正确的是( )