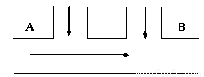
题目内容
某造纸厂排出的废水中含游离氯0.014 mol·L-1,含氢离子0.012 mol·L-1,排放速度为10 L·s-1,为了把此工业废水变成无游离氯的中性水,提出如下处理方案:在A、B两处分别注入0.1 mol·L-1的NaOH(aq),0.1 mol·L-1的Na2SO3(aq),通过计算完成问题:A、B两处各应注入何种溶液,流量各为多大?(提示:Cl2+Na2SO3+H2O====2HCl+Na2SO4)
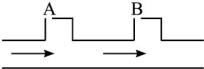
A处注入Na2SO3溶液,流量为1.4 L·s-1;B处注入NaOH溶液,流量为4.0 L·s-1。
解析:根据提示Cl2与Na2SO3反应要生成HCl,所以肯定在B处注入NaOH溶液,A处注入Na2SO3溶液,设A处流量为x,B处流量为y?
Cl2 + Na2SO3+H2O====2HCl+Na2SO4?
1 1 2
0.014 mol·L-1×10 L·s-1 0.1 mol·L-1·x n′(HCl)
x=1.4 L·s-1 n′(HCl)=0.28 mol·s-1
n(H+)=n′(HCl)+n(H+原)=0.28 mol·s-1+0.012 mol·L-1×10 L·s-1=0.40 mol·s-1
n(NaOH)=n(H+)=0.40 mol·s-1
y=![]() =4.0 L·s-1
=4.0 L·s-1

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目