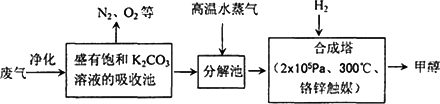
题目内容
(8分)某工厂排出的废水中含氯气,为了除去废水中游离态氯,而且使废水变为中性,有人提出如图所示方案。在废水排出管的A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液。
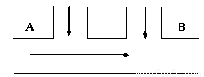
试写出:(1)A、B处应加入的物质的化学式为______________,_______________。
(2)A、B处反应离子方程式:
A:_________________________。B:__________ _______。
(1)NaSO3,NaOH (2)Cl2+SO32-+H2O = SO42-+2Cl- + 2H+ H++OH-=H2O
【解析】

| |||||||||||||||||||||||||||||||||