题目内容
3.已知:SO32-+I2+H2O═SO42-+2H++2I-,某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是( )| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 可能含有SO32- | D. | 可能含有I- |
分析 溶液无色说明一定不含Cu2+,向该无色溶液中加入少量溴水,溴水褪色,溶液呈无色,由于离子还原性SO32->I-,说明溶液中可以含I-,但一定含有还原性离子被溴单质氧化,判断一定含有SO32-,根据溶液电中性,阳离子只有NH4+,所以溶液中一定含有铵根离子.
解答 解:溶液为无色溶液,说明一定不含Cu2+,向该无色溶液中加入少量溴水,溴水褪色,溶液呈无色,由于离子还原性SO32->I-,说明溶液中可以含I-,但一定含有还原性离子被溴单质氧化,则一定含有SO32-;
根据分析可知,溶液中一定含有SO32-,一定不含Cu2+,可能含有I-,由于溶液电中性,则一定含有阳离子NH4+,
A.结合分析可知溶液中可以含有I-,故A错误;
B.根据分析可知,溶液中肯定含NH4+,故B错误;
C.原溶液中一定含有SO32-,故C错误;
D.加入的少量溴水,已知还原性SO32->I-,溴单质只氧化SO32-,溶液为无色,所以可能含有I-,故D正确;
故选D.
点评 本题考查了离子的检验,题目难度中等,明确亚硫酸根离子和碘离子还原性的相对强弱是解本题关键,注意熟练掌握常见离子的性质及检验方法.

练习册系列答案
相关题目
14.己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大.X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍.下列说法不正确的是( )
| A. | N的单质的晶体属于金属晶体;U的氢化物的球棍模型示意图为 | |
| B. | 工业上V的单质的制备可以电解熔融的NV | |
| C. | Z的最高价氧化物对应的水化物能与其气态氢化物反应生成盐 | |
| D. | X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物;也可形成结构式为X-W-Y≡Z的化合物 |
11.以下物质保存方法不正确的是( )
| A. | 少量金属钠保存在煤油中 | |
| B. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| C. | 氢氧化钠溶液保存在配有玻璃塞的细口瓶中 | |
| D. | 氢氟酸保存在塑料试剂瓶中 |
18.下列化学用语表达错误的是( )
| A. | NH3的电子式: | |
| B. | 氯离子的结构示意图: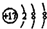 | |
| C. | CS2的结构式:S=C=S | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
15.下列反应的离子方程式正确的是( )
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向含有0.4 mol FeBr2溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe+3+6Cl-+Br2 | |
| D. | 用Pt电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
12.下列物质分类正确的一组是( )
| 选项 | A | B | C | D |
| 电解质 | 浓硫酸 | 胆矾 | 硫酸钡 | 冰醋酸 |
| 混合物 | 漂白粉 | 蛋白质 | 水玻璃 | 冰水混合物 |
| 酸性氧化物 | SO2 | Mn2O7 | SiO2 | NO2 |
| 酸 | HClO4 | H2SiO3 | NaHSO4 | CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
13.下列说法正确的是( )
| A. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 对于反应①C+CO2?2CO(△H>0)和反应②N2+3H2?2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢 | |
| D. | NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ |

 +2H2O;
+2H2O; ;
;