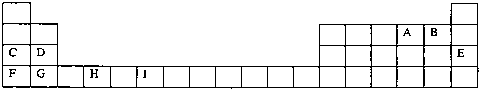
题目内容
已知M2+有2个电子层,则M在元素周期表中的位置是( )
分析:M2+离子有2个电子层,则原子核外有3个电子层,最外层电子数为2,以此判断元素在周期表中的位置.
解答:解:M2+离子有2个电子层,核外电子分别为2、8,则原子核外有3个电子层,最外层电子数为2,应位于周期表第三周期ⅡA族.
故选D.
故选D.
点评:本题考查元素在周期表中的位置,题目难度不大,注意离子或原子的核外电子排布特点,原子的电子层数等于周期数,最外层电子数等于族序数.

练习册系列答案
相关题目
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式 ,F位于周期表 区。
(2)A、B、C的第一电离能由小到大的顺序为 。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
|
元 素 |
M |
F |
|
|
电能 (kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子
难。对此,你的解释是 ;
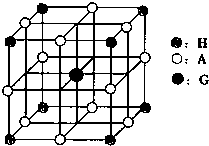
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为_______,一个晶胞中F原子的数目为______ 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202 |
2.6 |
|
H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
__________________________________。