题目内容
一定浓度的下列溶液,加入少量的Ba(OH)2固体后,溶液的导电能力变化最小的是( )
| A.蒸馏水 | B.稀硫酸 | C.盐酸 | D.NaOH溶液 |
C
解析试题分析:溶液的导电能力的大小与离子浓度大小有关,而与离子的种类无关。一定浓度的溶液中加入少量的Ba(OH)2固体后,变化最小说明离子的浓度变化最小。A水是若电解质,离子浓度很小当加入少量的Ba(OH)2固体后,自由移动的离子浓度大大增加,导电能力增强。错误。B硫酸中含大量自由移动的离子,当加入少量的Ba(OH)2固体后发生反应:H2SO4+Ba(OH)2=BaSO4↓+2H2O离子浓度减小。错误。C.盐酸中加入少量的Ba(OH)2固体尽管也会发生反应2HCl+Ba(OH)2=BaCl2+2H2O,但自由移动的离子个数不变,故导电能力几乎不变。正确。D中不会发生反应,但增加了Ba2+、OH-,自由移动离子浓度增加,导电能力增强。错误。
考点:考查溶液的导电性和离子的关系等的知识。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
在下列溶液中,能大量共存的一组离子是
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、ClO- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D.通入过量CO2气体的溶液中:Na+、Ba2+、HCO3-、Cl-、Br- |
在某无色透明的酸性溶液中,能大量共存的离子组是
| A.Na+ 、K+、SO42-、HCO3- | B.Na十、Ba2+、NO3-、SO42- |
| C.Na+、 K+、Cl-、 NO3- | D.Fe3+、K+、SO42-、OH- |
下列可以大量共存且溶液是无色的离子组是( )。
| A.H+、Na+、NO3-、Cu2+ | B.Ba2+、Mg2+、Cl-、SO42- |
| C.H+、K+、OH-、NO3- | D.NO3-、SO42-、K+、Mg2+ |
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
| A.K+、Ca2+、F-、NO3- | B.K+、Ba2+、Br-、NO3- |
| C.Na+、K+、CO32-、HCO3- | D.Na+、Ag+、NH3·H2O、NO3- |
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO2-3、SO32-、CO 32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:
下列判断错误的是
| A.气体甲可能是混合物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
| C.白色沉淀乙的主要成分是氢氧化铝 |
| D.K+、[Al(OH)4]-和SiO 32-一定存在于溶液X中 |
室温下,强酸性和强碱性溶液中都不能共存的离子组是
| A.Ba2+、Fe2+、NO3-、I- | B.K+、Na+、SO32-、S2- |
| C.K+、Na+、AlO2-、SO42- | D.NH4+、Cu2+、Cl-、NO3- |
能正确表示下列反应的离子方程式是
A.向0.1mol/L的Na2S溶液中加入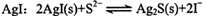 |
B.碳酸钠溶液显碱性的原因: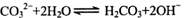 |
C.二氧化硫通入氯化铁溶液: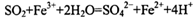 |
D.用醋酸清洗盛放石灰水试剂瓶内壁出现的白色固体: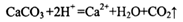 |
下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO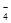 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |