题目内容
6.用实验法测定某氧化物FexOy的化学式,实验中称取3.48g该样品,向样品中逐滴加入3.0mol•L-1的稀盐酸,当加入40.0mL稀盐酸时样品恰好完全溶解,请列式计算确定该氧化物的化学式,若将所得溶液蒸干、灼热,所得固体的质量为3.6g.分析 首先根据加入3.0mol•L-1的稀盐酸,当加入40.0mL稀盐酸时样品恰好完全溶解,得到铁的氧化物的组成,将所得溶液蒸干、灼热,所得固体,是氧化铁,然后根据铁守恒求所得固体的质量.
解答 解:n(HCl)=0.04L×3mol/L=0.12mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,则氧化物中n(O)=$\frac{1}{2}$×n(HCl)=$\frac{1}{2}$×0.12mol=0.06mol,所以n(Fe)=$\frac{3.48g-0.06mol×16g/mol}{56g/mol}$=0.045mol,
同一化学式中各元素物质的量之比等于其系数之比,所以x:y=0.045mol:0.06mol=3:4,则氧化物化学式为Fe3O4;
溶液蒸干、灼热,所得固体氧化铁的物质的量为$\frac{0.045mol}{2}$=0.0225mol,则所得固体的质量为:0.0225mol×160g/mol=3.6g,故答案为:Fe3O4;3.6g.
点评 本题考查氧化还原反应的计算,题目难度中等,注意反应中HCl的H元素与氧化物中O元素全部结合生成H2O,求出铁元素的质量,然后得到氧化铁的质量,为解答该题的关键,做题时注意体会.

练习册系列答案
相关题目
20.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 NaOH H2O | D. | NH3 H2O CO2 |
14.某化学兴趣小组为提取海带中的碘,设计如图所示的流程,下列有关说法正确的是( )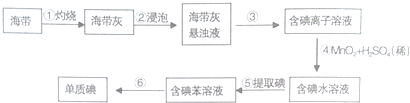

| A. | 步骤①④⑤均属于化学变化 | |
| B. | 步骤④中MnO2的作用是催化剂 | |
| C. | 步骤⑤所用主要仪器是分液漏斗、烧杯 | |
| D. | 步骤⑥操作名称是萃取、分液 |
1.在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移电子的物质的量为6 mol |
11.有机化合物A的分子式为C5H12O,且能与金属钠反应放出氢气,那么A的同分异构体的数目(包括A)为( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
18.氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,该族元素的化合物在研究和生产中有许多重要用途.下列有关说法正确的( )
| A. | H2O2、H2S、H2Se分子中均只含极性键 | |
| B. | 沸点:H2O<H2S<H2Se | |
| C. | 稳定性:H2O<H2S<H2Se | |
| D. | 上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4 |
15.下列各组物质中,化学键类型和化合物类型都相同的是( )
| A. | SO2和H2O | B. | CO2和Na2CO3 | C. | KOH和NaCl | D. | NaCl和HCl |


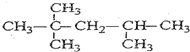 .
.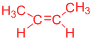 、
、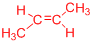 .
.