题目内容
【题目】(1)用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:光导纤维的主要成分是 ;目前应用最多的太阳能电池的光电转化材料是 ;
(2)某气态氧化物的化学式为XO2,在标准状况下,1.92 g 该氧化物的体积为672 mL,则该氧化物的摩尔质量为 _____。
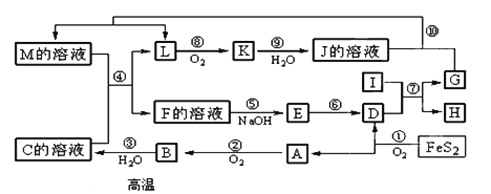
(3)某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验:
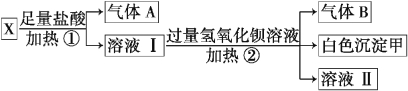
(1)白色沉淀甲是________。
(2)试写出实验过程中生成气体B的离子方程式 _________________________。
(3)通过上述实验,可确定X溶液中一定存在的离子是_______________________。
【答案】(1) SiO2(二氧化硅);Si(晶体硅);(2)64g/mol (3)BaSO4
NH4++OH-![]() NH3↑+H2O (3) NH4+、CO32-、SO42-
NH3↑+H2O (3) NH4+、CO32-、SO42-
【解析】
试题分析:(1)光导纤维的主要成分是二氧化硅;目前应用最多的太阳能电池的光电转化材料是晶体硅;
(2)标准状况下672mL气体的物质的量是0.672L÷22.4L/mol=0.03mol,所以该气态氧化物的摩尔质量=1.92g÷0.03mol=64g/mol。
(3)无色溶液,判断Fe3+不存在,加过量盐酸生成气体和溶液,判断溶液中一定含CO32﹣,则一定不含有Ba2+、Al3+;气体A为CO2;溶液I加入过量氢氧化钡反应生成气体B为氨气,一定有铵根离子,白色沉淀甲是硫酸钡,原溶液一定含有硫酸根。
①根据以上分析可知白色沉淀甲是硫酸钡;
②铵盐能与碱反应生成氨气,则实验过程中生成气体B的离子方程式NH+4+OH﹣![]() NH3↑+H2O;
NH3↑+H2O;
③根据以上分析可知X溶液中一定存在的离子是NH4+、CO32﹣、SO42﹣,一定不存在的离子是Fe3+、Ba2+、Al3+,尚未确定是否存在的离子是K+。

 阅读快车系列答案
阅读快车系列答案