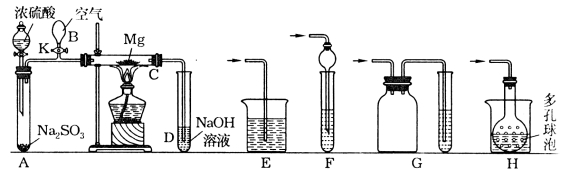
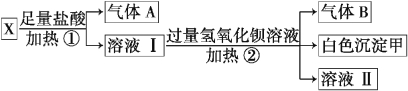
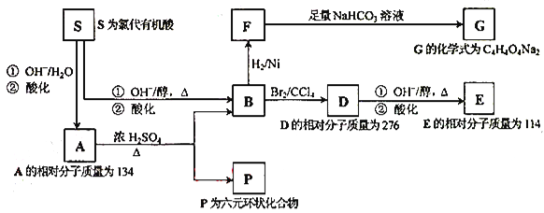
题目内容
【题目】已知:2A(g)+3B(g)![]() 2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2 s,A的转化率为40%,测得v(D)=0.2 mol·L-1·S-1,下列有关该反应的说法错误的是( )
2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2 s,A的转化率为40%,测得v(D)=0.2 mol·L-1·S-1,下列有关该反应的说法错误的是( )
A.z=2
B.2s末,反应物B的浓度为0.9mol·L-1
C.若反应再经2s达平衡,则平衡时生成物D的浓度为0.8mol·L-1
D.反应达平衡时,反应物A、B的分子数之比为2:3
【答案】C
【解析】
试题分析:A、A的转化率为40%,即消耗0.8mol,测得v(D)=0.2 mol·L-1·S-1,则生成D是0.2 mol·L-1·S-1×2L×2s=0.8mol,变化量之比是相应的化学计量数之比,则z=2,A正确;B、消耗B是1.2mol,则2s末,反应物B的浓度为![]() =0.9mol·L-1,B正确;C.随着反应的进行反应速率逐渐减小,则反应再经2s达平衡,则平衡时生成物D的浓度<0.8mol·L-1,C错误;D.由于A和B是按照化学计量数之比充入反应的,因此反应达平衡时,反应物A、B的分子数之比为2:3,D正确,答案选C。
=0.9mol·L-1,B正确;C.随着反应的进行反应速率逐渐减小,则反应再经2s达平衡,则平衡时生成物D的浓度<0.8mol·L-1,C错误;D.由于A和B是按照化学计量数之比充入反应的,因此反应达平衡时,反应物A、B的分子数之比为2:3,D正确,答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为____________。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 。增加压强,NO的转化率________________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率___________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)不同温度下,NaClO2溶液脱硫、脱硝反应中,SO2和NO的平衡分压Pe如图所示。
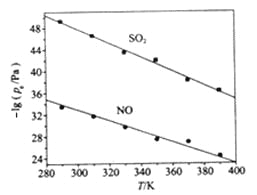
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH(aq)===SO32(aq)+H2O(l) ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH= _。